名校
解题方法
1 . 回答下列问题。
I.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量 AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是___________ ,可能含有的是___________ 。(写化学式)
(2)步骤②中的离子方程式___________ 。
Ⅱ.人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,用适量的小苏打(NaHCO3)能治疗胃酸过多。
(3)小苏打在水中的电离方程式:___________ 。
(4)不可以服用 BaCO3来治疗胃酸过多,理由是___________ 。
(5)如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是 Al(OH)3],反应的离子方程式为___________ 。
I.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量 AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是
(2)步骤②中的离子方程式
Ⅱ.人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,用适量的小苏打(NaHCO3)能治疗胃酸过多。
(3)小苏打在水中的电离方程式:
(4)不可以服用 BaCO3来治疗胃酸过多,理由是
(5)如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是 Al(OH)3],反应的离子方程式为
您最近一年使用:0次
2 . 纳米 和纳米
和纳米 均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米
均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米 和纳米
和纳米 的部分流程如下:
的部分流程如下:
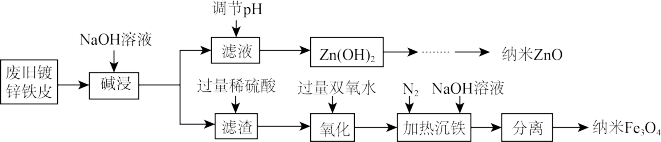
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:
(1)铁皮镀锌在金属的电化学防护中属于_______ 法。
(2)调节滤液pH时,pH不能太低的原因为_______ (用离子方程式表示)。
(3)向“碱浸”后得到的滤渣中加入过量稀硫酸时,硫酸不能过量太多的原因为_______ 。
(4)写出“氧化”阶段的离子方程式:_______ ;“加热沉铁”阶段需要持续通入 ,其原因为
,其原因为_______ 。
(5)若“分离”阶段在实验室中进行,可选用的实验装置为_______ (填字母)。
 和纳米
和纳米 均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米
均为多功能性的新型无机材料,在陶瓷、电子、光学等领域有着重要的应用价值。某科学小组尝试利用废旧镀锌铁皮制备纳米 和纳米
和纳米 的部分流程如下:
的部分流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:
(1)铁皮镀锌在金属的电化学防护中属于
(2)调节滤液pH时,pH不能太低的原因为
(3)向“碱浸”后得到的滤渣中加入过量稀硫酸时,硫酸不能过量太多的原因为
(4)写出“氧化”阶段的离子方程式:
 ,其原因为
,其原因为(5)若“分离”阶段在实验室中进行,可选用的实验装置为

您最近一年使用:0次
2022-09-07更新
|
456次组卷
|
2卷引用:河南省焦作市第一中学2022-2023学年高三上学期定位考试化学试题
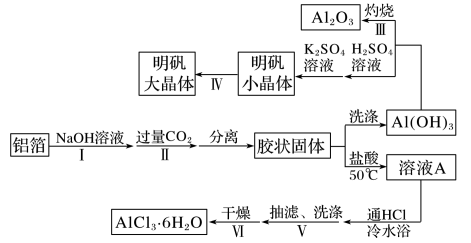
3 . 某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:
请回答:
(1)步骤Ⅰ中的化学方程式______________________________________ 。步骤Ⅱ中生成Al(OH)3的离子方程式________________________________________ 。
(2)步骤Ⅲ,下列操作合理的是______________________ 。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________ 。
①迅速降至室温 ②用玻璃棒摩擦器壁③配制90℃的明矾饱和溶液 ④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央⑥配制高于室温10~20℃的明矾饱和溶液
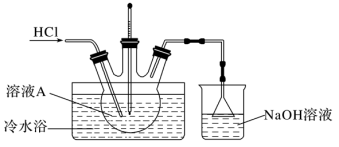
(4)由溶液A制备AlCl3·6H2O的装置如图:________________ 。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是____________________________ ;
洗涤时,合适的洗涤剂是______________________ 。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___________________ 。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| 溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)步骤Ⅰ中的化学方程式
(2)步骤Ⅲ,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序
①迅速降至室温 ②用玻璃棒摩擦器壁③配制90℃的明矾饱和溶液 ④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央⑥配制高于室温10~20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如图:
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是
洗涤时,合适的洗涤剂是
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
您最近一年使用:0次
2017-11-06更新
|
4634次组卷
|
6卷引用:浙江省2017年11月普通高校招生选考科目考试化学试题
浙江省2017年11月普通高校招生选考科目考试化学试题2017年11月浙江省普通高校招生选考科目考试化学试题2019届高三化学镁、铝及其化合物一轮复习针对训练题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)吉林省通化县综合高级中学2021-2022学年高三上学期第一次模拟考试化学试题江西省宁冈中学2021-2022学年高三上学期9月份开学考化学试题
4 . 绿色化学是当前化学研究的热点,为了实现经济可持续性发展,充分利用资源,某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3、MgO和SiO2等杂质)制备四氢铝锂(LiAlH4)和冰晶石(Na3AlF6)。四氢铝锂是有机合成的重要还原剂,冰晶石常作工业上冶炼铝的助熔剂。其工艺流程如下:

请回答下列问题:
(1)为了提高酸浸效率,除了升高温度,还可以增大硫酸的浓度,但硫酸浓度增大到一定数值后,浸出率反而降低,原因是_______
(2)滤渣2的主要成分是_______ 。
(3)AlCl3溶于水导电,但熔融时不导电原因是_______ 。
(4)写出滤液2与足量CO2反应的离子方程式:_______ 。
(5)根据流程发生反应2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O制备冰晶石,该反应不能在玻璃容器中进行的原因是_______ (用化学方程式来解释)。
(6)根据方程式2Fe3++Fe=3Fe2+设计电池。
①画出装置图,标出电极材料、名称、电子流向及电解质溶液_______ ;
②写出电极反应式_______ 。

请回答下列问题:
(1)为了提高酸浸效率,除了升高温度,还可以增大硫酸的浓度,但硫酸浓度增大到一定数值后,浸出率反而降低,原因是
(2)滤渣2的主要成分是
(3)AlCl3溶于水导电,但熔融时不导电原因是
(4)写出滤液2与足量CO2反应的离子方程式:
(5)根据流程发生反应2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O制备冰晶石,该反应不能在玻璃容器中进行的原因是
(6)根据方程式2Fe3++Fe=3Fe2+设计电池。
①画出装置图,标出电极材料、名称、电子流向及电解质溶液
②写出电极反应式
您最近一年使用:0次
解题方法
5 . 明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的实验流程如下:

(1)“碱溶”步骤中发生反应的化学方程式为_______ 。
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3。检验“沉铝所得滤液中阳离子的操作为_______ 。
(3)由浓硫酸配制250 mL“酸溶”所需的9 mol/H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、_______ 、_______ 。
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是_______ ,圆底烧瓶中发生反应的离子方程式为_______ 。

(5)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如图所示:

请将制备明矾晶体的实验方案补充完整:将“酸溶”所得溶液转移至蒸发皿中,_______ ,过滤,冷水洗涤,干燥,得到明矾晶体(实验中需用到的试剂:K2SO4固体)。

(1)“碱溶”步骤中发生反应的化学方程式为
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3。检验“沉铝所得滤液中阳离子的操作为
(3)由浓硫酸配制250 mL“酸溶”所需的9 mol/H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是

(5)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如图所示:

请将制备明矾晶体的实验方案补充完整:将“酸溶”所得溶液转移至蒸发皿中,
您最近一年使用:0次
6 . 粉煤灰的综合利用既有利于节约资源,又有利于保护环境。以粉煤灰(主要含 、
、 、
、 等)为原料制取
等)为原料制取 的一种工艺流程如下:
的一种工艺流程如下:

(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)沉铝、铁后,检验溶液中是否还含有 的方法是
的方法是_______ 。
(3)蒸氨时反应的离子方程式为_______ 。
(4)过滤所得 和
和 经过分离后可以制取
经过分离后可以制取 溶液。
溶液。
①过滤后沉淀需要洗涤,检验沉淀是否洗涤干净的方法是_______ 。
②设计由 和
和 制取
制取 溶液的实验方案:
溶液的实验方案:_______ 。(实验中可以使用的试剂是盐酸和NaOH溶液)
 、
、 、
、 等)为原料制取
等)为原料制取 的一种工艺流程如下:
的一种工艺流程如下:
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)沉铝、铁后,检验溶液中是否还含有
 的方法是
的方法是(3)蒸氨时反应的离子方程式为
(4)过滤所得
 和
和 经过分离后可以制取
经过分离后可以制取 溶液。
溶液。①过滤后沉淀需要洗涤,检验沉淀是否洗涤干净的方法是
②设计由
 和
和 制取
制取 溶液的实验方案:
溶液的实验方案:
您最近一年使用:0次
名校
7 . 铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
(2)铝元素在周期表中的位置是_______ 。写出 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式_______ 。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______ 。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。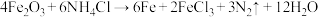 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______ 个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______ 。
(4)现有仪器和药品:试管和胶头滴管,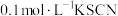 溶液、
溶液、 酸性
酸性 溶液、
溶液、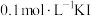 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
| A.不易生锈 | B.导电性好 | C.密度小 | D.硬度大 |
 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
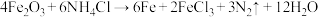 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为(4)现有仪器和药品:试管和胶头滴管,
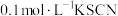 溶液、
溶液、 酸性
酸性 溶液、
溶液、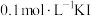 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴 溶液。 溶液。 | |
| 第二步 |  。 。 |
您最近一年使用:0次
2022-06-28更新
|
230次组卷
|
2卷引用:上海市宜川中学2021-2022学年高一下学期期末考试化学试题
8 . (I)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置为:___________ ,属于___________ 元素(填“金属”或“非金属”)。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,回答下列问题:
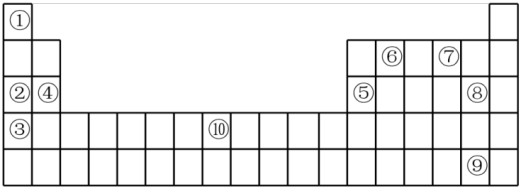
(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是___________ (填化学式)。
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为___________ ;
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为___________ ;
(5)元素⑩为铁,其单质与⑧的单质反应的化学方程式为___________ ;
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是___________
(1)该元素在周期表中的位置为:
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,回答下列问题:

(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为
(5)元素⑩为铁,其单质与⑧的单质反应的化学方程式为
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是___________
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A.L2+、R2-的核外电子数相等 |
| B.单质与稀盐酸反应的速率L<Q |
| C.M与T形成的化合物具有两性 |
| D.T与R可形成的化合物TR2、TR3 |
您最近一年使用:0次
名校
解题方法
9 . 聚合硫酸铝铁(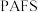 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为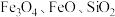 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为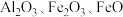 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下:___________ (填序号)。
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有___________ (填化学符号)。
(2)检验“氧化”后溶液中金属阳离子的方法是___________ 。
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是___________ 。
(4)“酸溶”过程中发生反应的离子方程式为___________ 。
(5)滤渣Ⅱ中可以循环利用的物质是___________ (填化学式)。
 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为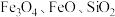 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为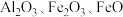 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下: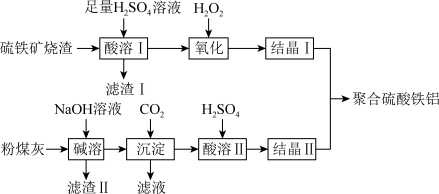
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有
(2)检验“氧化”后溶液中金属阳离子的方法是
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是
(4)“酸溶”过程中发生反应的离子方程式为
(5)滤渣Ⅱ中可以循环利用的物质是
您最近一年使用:0次
2024-04-24更新
|
195次组卷
|
2卷引用:江苏省盐城市五校联考2023-2024学年高一下学期4月期中考试化学试题
解题方法
10 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度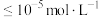 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度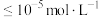 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次



