1 . 欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时过滤,并将沉淀灼烧,最后得到红棕色粉末,经称量恰好与原合金的质量相等,则合金中铁的质量分数是
| A.30% | B.50% | C.70% | D.85% |
您最近一年使用:0次
2 . 铁有+2价和+3价两种价态,下列有关反应中不涉及铁元素价态变化的是
| A.铁与稀硫酸反应 |
| B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐 |
| C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色 |
| D.氢氧化铁受热分解 |
您最近一年使用:0次
3 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
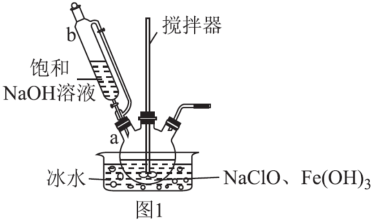
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
(3)用图2所示装置检验K2FeO4受热分解的产物。
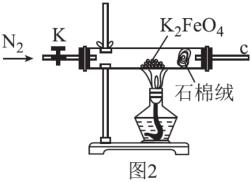
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
您最近一年使用:0次
2021-08-28更新
|
551次组卷
|
4卷引用:3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)河南部分学校2022届新高三8月份摸底联考化学试题安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题
解题方法
4 . 已知固体A是常见的金属,可发生以下转化:
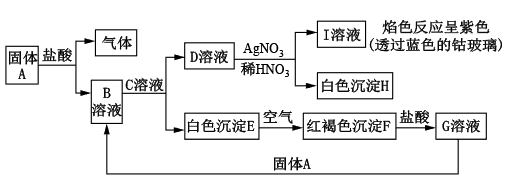
试回答下列问题。
(1)B的化学式为_______ ,D的化学式为_______ 。
(2)写出由E转变成F的化学方程式_______ 。
(3)常用来鉴别G溶液中所含金属阳离子的试剂是_______ ,向G溶液中加入A,发生反应的离子方程式为_______ 。

试回答下列问题。
(1)B的化学式为
(2)写出由E转变成F的化学方程式
(3)常用来鉴别G溶液中所含金属阳离子的试剂是
您最近一年使用:0次
2021-06-05更新
|
272次组卷
|
2卷引用:(苏教版2019)必修第二册专题9 金属与人类文明 第二单元 探究铁及其化合物的转化
解题方法
5 . 某同学模拟2019年春晚节目《魔壶》进行实验。将“魔壶”中盛有的FeCl3溶液依次倒入分别盛有约1mL①KSCN、②AgNO3、③NaOH浓溶液的3个烧杯中,实验现象各异。下列有关说法正确的是
| A.烧杯①中,有血红色沉淀生成 |
| B.烧杯②中,发生了氧化还原反应 |
| C.烧杯③中,反应后所得分散系属于胶体 |
| D.若用FeCl2溶液代替FeCl3溶液进行上述实验,实验现象各异 |
您最近一年使用:0次
名校
解题方法
6 . 下列离子方程式书写正确的是
A.实验室用氯化铵和熟石灰制氨:NH +OH- +OH- NH3↑+H2O NH3↑+H2O |
B.NaOH溶液与NH4Cl溶液混合加热:NH +OH- +OH- NH3·H2O NH3·H2O |
C.氨水中加盐酸:NH3·H2O+H+=NH +H2O +H2O |
D.氨水中加入氯化铁溶液:Fe2++2NH3·H2O=2NH +Fe(OH)2↓ +Fe(OH)2↓ |
您最近一年使用:0次
2021-05-31更新
|
537次组卷
|
12卷引用:5.2.2 氨和铵盐——2020年春高一新人教版第二册化学一课一练
5.2.2 氨和铵盐——2020年春高一新人教版第二册化学一课一练2020年春高一化学新人教版第二册课后同步:5.2.2 氨和铵盐步步为赢 高二化学暑假作业:作业五 非金属及其化合物山西省怀仁市大地学校2020-2021学年高一下学期第三次月考化学试题(已下线)第08讲 氨气-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题(已下线)第17讲 氨的转化与生成-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)课前-3.3.2氨的转化与生成(课前)-鲁科版2019必修第一册 山东省济宁市嘉祥县第一中学2022-2023学年高一下学期3月月考化学试题 辽宁省鞍山市普通高中2022-2023学年高一下学期期中考试化学(A卷)试题山东省济宁市嘉祥县第一中学2023-2024学年高一下学期第一次月考化学试题
7 . 以含Fe2O3、FeO、SiO2、A12O3的混合物为原料,设计两种制备铁红(Fe2O3)的一种方案,部分产物已略去。

其中第③步试剂X体积(ml)与产生沉淀质量(g)的关系如图所示。
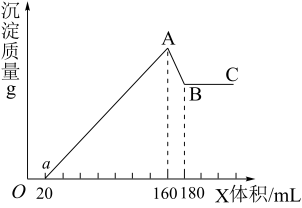
回答下列问题:
(1)溶液B中的溶质是_______ (填化学式)
(2)第②步的化学方程式为_______ 。
(3)试剂X的溶质可能是_______ (选填编号)
A.HNO3 B.NaHCO3 C. NH3.H2O D.NaOH
加入足量试剂X后,应进行的操作名称是_______ 。
(4)若试剂X的浓度为5mol/L,则固体中Al2O3的质量是_______ g。最终得到铁红的质量是_______ g(保留一位小数)

其中第③步试剂X体积(ml)与产生沉淀质量(g)的关系如图所示。

回答下列问题:
(1)溶液B中的溶质是
(2)第②步的化学方程式为
(3)试剂X的溶质可能是
A.HNO3 B.NaHCO3 C. NH3.H2O D.NaOH
加入足量试剂X后,应进行的操作名称是
(4)若试剂X的浓度为5mol/L,则固体中Al2O3的质量是
您最近一年使用:0次
2021-03-08更新
|
157次组卷
|
3卷引用:9.2.2反应条件影响的探究(课后)-2019苏教版必修2课前课中课后
9.2.2反应条件影响的探究(课后)-2019苏教版必修2课前课中课后上海市黄浦区格致中学2020-2021学年高二上学期期末化学试题(已下线)第13讲 铁的氧化物和铁的氢氧化物-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)
解题方法
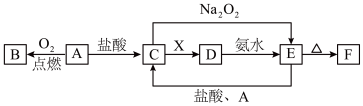
8 . 根据如下框图分析,下列说法不正确的是(已知氨水显碱性,为 溶于水形成的溶液)( )
溶于水形成的溶液)( )
 溶于水形成的溶液)( )
溶于水形成的溶液)( )
A.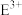 的氧化性比 的氧化性比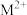 的氧化性强 的氧化性强 |
B.在反应①中 既表现了酸性,又表现了氧化性 既表现了酸性,又表现了氧化性 |
C.反应④的离子方程式可表示为 |
| D.在反应③中若不加稀硫酸可能看到红褐色沉淀生成 |
您最近一年使用:0次
2020-09-05更新
|
322次组卷
|
2卷引用:人教版(2019)高一必修第一册第三章 铁 金属材料 素养拓展区
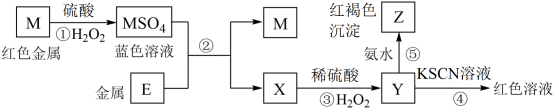
9 . 中学化学中几种常见物质的转化关系如下:
 为常见金属单质,将
为常见金属单质,将 的浓溶液滴入氨水中可以得到红褐色沉淀
的浓溶液滴入氨水中可以得到红褐色沉淀 。请回答下列问题:
。请回答下列问题:
(1)写出物质 的化学式:
的化学式:________ 。
(2) 、
、 都可用于工业上冶炼金属铁,以
都可用于工业上冶炼金属铁,以 为原料冶炼铁的原理是
为原料冶炼铁的原理是______ (用化学方程式表示),若有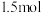
 参加反应,转移电子的物质的量是
参加反应,转移电子的物质的量是______ ;写出 的另一种用途:
的另一种用途:_______ 。
(3)写出下列过程的离子方程式。

________ ;
_________ 。
(4)制造电路板工艺中,用 溶液刻蚀铜箔,用离子方程式表示该反应原理:
溶液刻蚀铜箔,用离子方程式表示该反应原理:_____ 。
(5)在 溶液中加入
溶液中加入 ,恰好使
,恰好使 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:____ 。

 为常见金属单质,将
为常见金属单质,将 的浓溶液滴入氨水中可以得到红褐色沉淀
的浓溶液滴入氨水中可以得到红褐色沉淀 。请回答下列问题:
。请回答下列问题:(1)写出物质
 的化学式:
的化学式:(2)
 、
、 都可用于工业上冶炼金属铁,以
都可用于工业上冶炼金属铁,以 为原料冶炼铁的原理是
为原料冶炼铁的原理是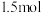
 参加反应,转移电子的物质的量是
参加反应,转移电子的物质的量是 的另一种用途:
的另一种用途:(3)写出下列过程的离子方程式。


(4)制造电路板工艺中,用
 溶液刻蚀铜箔,用离子方程式表示该反应原理:
溶液刻蚀铜箔,用离子方程式表示该反应原理:(5)在
 溶液中加入
溶液中加入 ,恰好使
,恰好使 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
您最近一年使用:0次
2020-09-05更新
|
336次组卷
|
4卷引用:人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 课时2 铁盐、亚铁盐
解题方法
10 . 《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
铁器在具有 、
、_____ 等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ. 转化为
转化为 。
。
Ⅱ. 在自然环境中形成
在自然环境中形成 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为_______ 。
Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层,
保护层, 的作用是
的作用是_______ 。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ. 保护层被氧化为
保护层被氧化为 ,如此往复腐蚀,
,如此往复腐蚀,___  +
+___  +
+___ 

____  (将反应补充完整)
(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成 保护层,方法如下: 将铁器浸没在盛有
保护层,方法如下: 将铁器浸没在盛有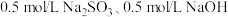 溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用
溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用 溶液洗涤至无Cl-。
溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____ 。
②脱氯反应: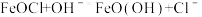 。离子反应的本质是离子浓度的减小,比较
。离子反应的本质是离子浓度的减小,比较 与
与 溶解度的大小:
溶解度的大小:__________ 较大。[填 与
与 ]
]
(1)检测锈蚀产物
| 主要成分的化学式 | |||
 |  |  |  |
铁器在具有
 、
、(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.
 转化为
转化为 。
。Ⅱ.
 在自然环境中形成
在自然环境中形成 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为Ⅲ.
 和
和 反应形成致密的
反应形成致密的 保护层,
保护层, 的作用是
的作用是a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.
 保护层被氧化为
保护层被氧化为 ,如此往复腐蚀,
,如此往复腐蚀, +
+ +
+

 (将反应补充完整)
(将反应补充完整)(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成
 保护层,方法如下: 将铁器浸没在盛有
保护层,方法如下: 将铁器浸没在盛有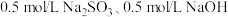 溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用
溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用 溶液洗涤至无Cl-。
溶液洗涤至无Cl-。①检测洗涤液中 Cl-的方法是
②脱氯反应:
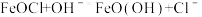 。离子反应的本质是离子浓度的减小,比较
。离子反应的本质是离子浓度的减小,比较 与
与 溶解度的大小:
溶解度的大小: 与
与 ]
]
您最近一年使用:0次



