1 . 实验目的:为研究铁质材料与热浓硫酸的反应
(1)称取铁钉(碳素钢 )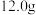 放入
放入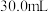 浓硫酸中,加热,充分反应后得到溶液
浓硫酸中,加热,充分反应后得到溶液 并收集到气体
并收集到气体 。
。
①甲同学认为 中除
中除 外还可能含有
外还可能含有 。若要确认其中是否含有
。若要确认其中是否含有 ,应选择加入的试剂为
,应选择加入的试剂为___________ (选填序号)
A. 溶液和氯水 B.铁粉和
溶液和氯水 B.铁粉和 溶液 C.浓氨水 D.酸性
溶液 C.浓氨水 D.酸性 溶液
溶液
②乙同学取 (标准状况)气体
(标准状况)气体 通入足量溴水中,然后加入足量
通入足量溴水中,然后加入足量 溶液,经适当操作后得到干燥固体
溶液,经适当操作后得到干燥固体 。据此推知气体
。据此推知气体 中
中 的体积分数为
的体积分数为___________ 。(保留三位有效数字)。
(2)分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和
和 气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有
气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有 的原因是
的原因是___________ 。

(3)装置A中试剂的作用是___________ ,反应的离子方程式___________ 。
(4)简述确认气体Y中含有 的实验现象
的实验现象___________ 。
(5)如果气体Y中含有 ,预计实验现象应是
,预计实验现象应是___________ 。
(1)称取铁钉(
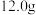 放入
放入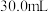 浓硫酸中,加热,充分反应后得到溶液
浓硫酸中,加热,充分反应后得到溶液 并收集到气体
并收集到气体 。
。①甲同学认为
 中除
中除 外还可能含有
外还可能含有 。若要确认其中是否含有
。若要确认其中是否含有 ,应选择加入的试剂为
,应选择加入的试剂为A.
 溶液和氯水 B.铁粉和
溶液和氯水 B.铁粉和 溶液 C.浓氨水 D.酸性
溶液 C.浓氨水 D.酸性 溶液
溶液②乙同学取
 (标准状况)气体
(标准状况)气体 通入足量溴水中,然后加入足量
通入足量溴水中,然后加入足量 溶液,经适当操作后得到干燥固体
溶液,经适当操作后得到干燥固体 。据此推知气体
。据此推知气体 中
中 的体积分数为
的体积分数为(2)分析上述实验中
 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和
和 气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有
气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有 的原因是
的原因是
(3)装置A中试剂的作用是
(4)简述确认气体Y中含有
 的实验现象
的实验现象(5)如果气体Y中含有
 ,预计实验现象应是
,预计实验现象应是
您最近一年使用:0次
2021-10-10更新
|
285次组卷
|
5卷引用:2014-2015江西省临川市第一中学高一上学期期末化学试卷
2 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
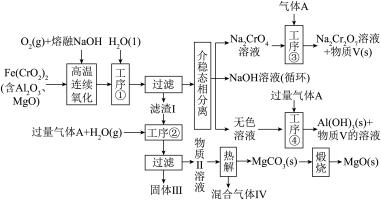
回答下列问题:
(1)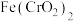 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:_________ 。
(2)滤渣Ⅰ的主要成分是_________ (填化学式)。工序③中发生反应的离子方程式为_________ 。
(3)热解工序产生的混合气体Ⅳ最适宜返回工序_________ (填“①”或“②”或“③”或“④”)参与内循环。
(4) 难溶于水,常温时
难溶于水,常温时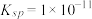 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。
①欲使 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为_________  的
的 溶液。
溶液。
②20℃时,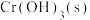 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确_________ 的是(填字母)。
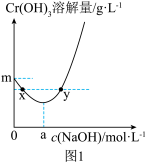
A.NaOH浓度越小,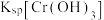 越小
越小
B.x、y两点对应的溶液中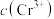 不相等
不相等
C.当NaOH浓度小于 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动
D.当NaOH浓度为 时,溶液中
时,溶液中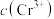 一定最小
一定最小
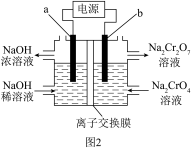
(5)工序③也可以利用电解法制 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为_________ (填离子符号)交换膜。制备 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少_________ g。
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
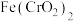 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:(2)滤渣Ⅰ的主要成分是
(3)热解工序产生的混合气体Ⅳ最适宜返回工序
(4)
 难溶于水,常温时
难溶于水,常温时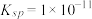 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。①欲使
 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为 的
的 溶液。
溶液。②20℃时,
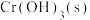 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确
A.NaOH浓度越小,
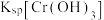 越小
越小B.x、y两点对应的溶液中
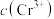 不相等
不相等C.当NaOH浓度小于
 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动D.当NaOH浓度为
 时,溶液中
时,溶液中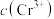 一定最小
一定最小(5)工序③也可以利用电解法制
 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
您最近一年使用:0次
2022-11-30更新
|
992次组卷
|
5卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题江西省宁冈中学2022-2023学年高三上学期12月月考化学试题江西省吉安市第三中学2022-2023学年高三上学期12月月考化学试题
名校
3 . 用下面两种方祛可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)制取所需的FeSO4溶液需要的反应物为_______ 。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________ 。
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(3)在试管Ⅰ里加入的试剂是________________________________________ 。
(4)在试管Ⅱ里加入的试剂是________________________________________ 。
操作:先打开止水夹,使I管中反应一段时间后再夹紧止水夹,实验中观察到I管中溶液被压入II管中,II中发生反应的离子方程式为:_____________ 。
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________ 。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)制取所需的FeSO4溶液需要的反应物为
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(3)在试管Ⅰ里加入的试剂是
(4)在试管Ⅱ里加入的试剂是
操作:先打开止水夹,使I管中反应一段时间后再夹紧止水夹,实验中观察到I管中溶液被压入II管中,II中发生反应的离子方程式为:
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
您最近一年使用:0次
2017-03-06更新
|
248次组卷
|
2卷引用:江西省临川实验学校2017-2018学年高一上学期期末质量检测化学试题



