1 . 为探究 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制:50mL1.0mol/L 的溶液,测其pH约为0.7,即
的溶液,测其pH约为0.7,即 。用离子方程式解释
。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:_______ 。
(2)小组同学利用上述 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:
①红褐色沉淀是:_______ (填化学式),结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:_______ 。
②反应后溶液为浅绿色,写出相关反应的离子方程式:_______ 。
③黑色固体中一定含有的物质是_______ ,为探究黑色固体中是否含有单质Fe,进行了下列实验:
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,黑色固体部分溶解(已知:Zn能与NaOH溶液发生反应: );
);
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,_______ ,证明有单质Fe。
(3)为进一步探究上述1.0mol/L 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在1.0mol/L 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)配制:50mL1.0mol/L
 的溶液,测其pH约为0.7,即
的溶液,测其pH约为0.7,即 。用离子方程式解释
。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:(2)小组同学利用上述
 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:| 操作 | 现象 |
向反应瓶中加入6.5g锌粉,然后加入50mL1.0mol/L的 溶液,搅拌 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
②反应后溶液为浅绿色,写出相关反应的离子方程式:
③黑色固体中一定含有的物质是
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,黑色固体部分溶解(已知:Zn能与NaOH溶液发生反应:
 );
);ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,
(3)为进一步探究上述1.0mol/L
 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:| 操作 | 现象 |
将5mL1.0mol/L的 溶液与0.65g锌粉混合 溶液与0.65g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将 | 溶液中立即产生大量气泡 |
 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
您最近一年使用:0次
解题方法
2 . 氧化铁俗名铁红,是重要的铁的氧化物。
流程一:制备氧化铁
用废铁屑制备氧化铁的流程如图:___________ 。
(2)操作Ⅱ为洗涤操作,简述洗涤沉淀的方法___________ 。
(3)写出“煅烧”发生反应的化学方程式___________ 。
流程二:探究氧化铁的性质
A、B、C、D均是含铁元素的物质,氧化铁发生的反应及物质转化关系如图:___________ 。
(5)A溶液可作为腐蚀液,将铜电路板中不需要的铜腐蚀掉。写出该反应的离子方程式___________ 。
(6)描述白色沉淀C与O2反应的现象___________ ;写出该过程中发生反应的化学方程式___________ 。
流程一:制备氧化铁
用废铁屑制备氧化铁的流程如图:
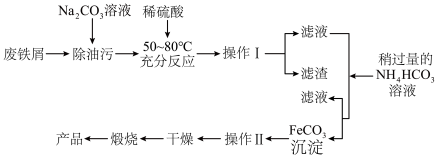
(2)操作Ⅱ为洗涤操作,简述洗涤沉淀的方法
(3)写出“煅烧”发生反应的化学方程式
流程二:探究氧化铁的性质
A、B、C、D均是含铁元素的物质,氧化铁发生的反应及物质转化关系如图:
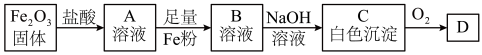
(5)A溶液可作为腐蚀液,将铜电路板中不需要的铜腐蚀掉。写出该反应的离子方程式
(6)描述白色沉淀C与O2反应的现象
您最近一年使用:0次
3 . 印刷电路板 是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用
是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用 溶液制作PCB并将腐蚀后废液回收再生的流程如图:
溶液制作PCB并将腐蚀后废液回收再生的流程如图:
 是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用
是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用 溶液制作PCB并将腐蚀后废液回收再生的流程如图:
溶液制作PCB并将腐蚀后废液回收再生的流程如图: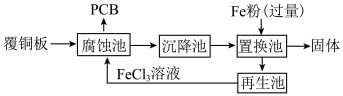
| A.把预先设计好的电路在覆铜板上可用蜡覆盖,以保护不被腐蚀 |
B.由腐蚀池中发生反应可知:氧化性: |
C.再生池中可加入酸化的 ,随着反应的逐步进行,池中的pH逐渐降低 ,随着反应的逐步进行,池中的pH逐渐降低 |
D.置换池中发生的主要反应为: 和 和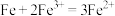 |
您最近一年使用:0次
4 . 把1.0mol/LCuSO4溶液和1.0mol/LFe2(SO4)3溶液等体积混合(假设混合溶液的体积等于混合前两溶液的体积之和),再向其中加入足量铁粉,经过足够长的时间后,铁粉有剩余。则此时溶液中Fe2+的物质的量浓度为
| A.1.5mol/L | B.2.0mol/L | C.2.5mol/L | D.3.0mol/L |
您最近一年使用:0次
2024-03-01更新
|
57次组卷
|
2卷引用:湖北省咸宁市崇阳县第二高级中学2023-2024学年高一下学期3月月考化学试题
5 . 室温下,某化学研究小组通过下列3组实验探究 溶液的性质。
溶液的性质。
已知:① 最高价为
最高价为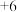 ;
;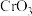 与
与 的反应为
的反应为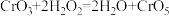 (深蓝色)。
(深蓝色)。
② 溶液呈弱酸性。
溶液呈弱酸性。
根据实验操作和现象,下列有关推论错误的是
 溶液的性质。
溶液的性质。| 实验 | 实验操作和现象 |
| I | 向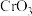 溶液中滴加少量 溶液中滴加少量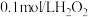 溶液,溶液变深蓝色 溶液,溶液变深蓝色 |
| II | 向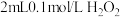 溶液中滴加少量 溶液中滴加少量 溶液,溶液迅速变黄,稍后产生气体;再加入几滴 溶液,溶液迅速变黄,稍后产生气体;再加入几滴 溶液,溶液变红 溶液,溶液变红 |
| III | 向 溶液中滴加少量酚酞,溶液变红,向其中滴加3~5滴 溶液中滴加少量酚酞,溶液变红,向其中滴加3~5滴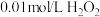 溶液,振荡,溶液逐渐褪色 溶液,振荡,溶液逐渐褪色 |
 最高价为
最高价为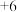 ;
;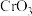 与
与 的反应为
的反应为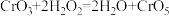 (深蓝色)。
(深蓝色)。②
 溶液呈弱酸性。
溶液呈弱酸性。根据实验操作和现象,下列有关推论错误的是
| A.实验I中溶液变深蓝色,该反应为非氧化还原反应 |
B.实验Ⅱ中前一段溶液迅速变黄,体现了 的氧化性 的氧化性 |
C.实验Ⅱ中稍后产生气体,体现了生成的 对 对 分解起催化作用 分解起催化作用 |
D.实验Ⅲ中溶液逐渐褪色,体现了 的弱酸性 的弱酸性 |
您最近一年使用:0次
2024-07-30更新
|
196次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年(新)高三上学期7月月考化学试题
名校
6 . 取一定体积的两种试剂进行反应,改变两种试剂的添加顺序(浓度均为0.1 mol/L),反应现象没有明显差别的是
| 选项 | 试剂① | 试剂② |
| A |  溶液 溶液 | 稀盐酸 |
| B |  溶液 溶液 |  溶液 溶液 |
| C |  溶液 溶液 |  溶液 溶液 |
| D | NaOH溶液 |  溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 下列实验现象和结论不相符的是
| 操作及现象 | 结论 | |
| A | 向某溶液中加入 溶液,产生红褐色沉淀 溶液,产生红褐色沉淀 | 溶液中没有 |
| B | 向盛 固体的试管中滴入少量水并用温度计检测,温度计读数降低 固体的试管中滴入少量水并用温度计检测,温度计读数降低 |  溶于水伴有吸热现象 溶于水伴有吸热现象 |
| C | 氢气可在氯气中安静燃烧,发出苍白色火焰 | 燃烧不一定需要氧气 |
| D | 向某溶液中加入 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 溶液中可能含有 或 或 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-04更新
|
171次组卷
|
3卷引用:湖北省部分重点中学2023-2024学年高一上学期元月期末考试化学试题
湖北省部分重点中学2023-2024学年高一上学期元月期末考试化学试题湖北省部分重点中学2023-2024学年高一上学期元月期末考试化学试卷(已下线)5.1.3硫酸根离子的检验和含硫化合物的转化课后作业提高篇
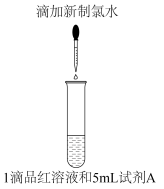
8 . 某项目式学习小组设计如表所示实验,探究饱和AgNO3溶液对新制氯水的漂白性的影响,褪色时间的差异引起该小组的讨论。
查阅资料:Ksp(AgCl)<Ksp(AgClO)。回答下列问题:
(1)Cl2和H2O反应的离子方程式为________ 。
(2)甲同学认为X为AgCl,乙同学认为甲是错误的,乙的证据是_______ 。
(3)丙同学认为X为AgClO,丁同学认为丙是错误的,丁的证据是_______ 。
(4)为了验证X除AgCl外还含有AgClO,该小组取过滤、洗涤后的X分别装入3支洁净的试管中,进行如表所示的实验:
(5)取新制氯水与足量饱和AgNO3溶液反应后得到的固体,用蒸馏水洗涤3次,干燥后称取8.93g装入一洁净试管,测得总质量为16.43g,用酒精灯加热,待氧气释放完全并恢复至室温,测得试管总质量为16.11g,则白色固体中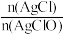 =
=_______ 。
| 实验步骤 | 试剂A | 现象 |
| 蒸馏水 | 8s后品红溶液褪色 |
| 饱和AgNO3溶液 | 生成白色沉淀(X),10min后品红溶液褪色 |
(1)Cl2和H2O反应的离子方程式为
(2)甲同学认为X为AgCl,乙同学认为甲是错误的,乙的证据是
(3)丙同学认为X为AgClO,丁同学认为丙是错误的,丁的证据是
(4)为了验证X除AgCl外还含有AgClO,该小组取过滤、洗涤后的X分别装入3支洁净的试管中,进行如表所示的实验:
| 实验序号 | 加入试剂及操作 | 实验现象 | 解释 |
| ① | 加入2mL浓盐酸,用湿润的淀粉KI试纸靠近试管口 | 产生黄绿色气体,淀粉KI试纸变蓝 | 产生气体的化学方程式为 |
| ② | 加入2mL(NH4)2Fe(SO4)2溶液,再滴加3滴 | 溶液出现红色 | |
| ③ | 加入饱和NaCl溶液,静置1小时,取上层清液,滴加1滴品红溶液 | 品红溶液褪色 |
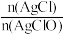 =
=
您最近一年使用:0次
2023-09-14更新
|
282次组卷
|
2卷引用:湖北省高中名校联盟2024届高三第一次联合测评化学试题
解题方法
9 . 工业废水任意排放,是造成环境污染的最大祸首。协同去污,变废为宝,为处理工业废水提供了新思路。永固电镀厂产生大量含FeSO4、CuSO4的电镀废液,水光皮革厂产生大量含K2Cr2O7的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂Cr2(SO4)3•6H2O,工艺流程如图:
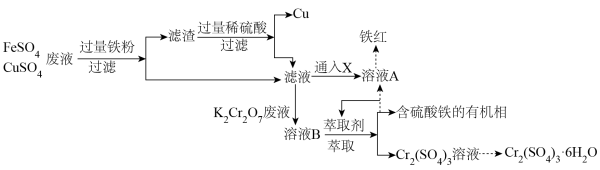
(1)K2Cr2O7中Cr元素的化合价为_______ 。
(2)处理滤渣时,要保持通风,并严禁烟火,其原因是_______ 。
(3)滤液可以通入X一步转化为溶液A,检验溶液A中金属阳离子的试剂是______ ,X可以是下列选项中的哪些物质_______ 。
A.CO2 B.O2 C.Cl2 D.SO2
(4)滤液与含K2Cr2O7的废液反应的离子方程式为_______ 。
(5)从Cr2(SO4)3溶液制取Cr2(SO4)3•6H2O晶体的实验操作方法为_______ 、_______ 、过滤、洗涤、干燥。
(6)已知Cr(OH)3化学性质与Al(OH)3类似,选择合适的化学试剂,将流程中的Cr2(SO4)3溶液转化为可用于陶瓷和搪瓷的着色剂Cr2O3(绿色粉末,广泛用于陶瓷和搪瓷的着色剂),转化过程中发生的主要的化学方程式为:_______ 、_______ 。

(1)K2Cr2O7中Cr元素的化合价为
(2)处理滤渣时,要保持通风,并严禁烟火,其原因是
(3)滤液可以通入X一步转化为溶液A,检验溶液A中金属阳离子的试剂是
A.CO2 B.O2 C.Cl2 D.SO2
(4)滤液与含K2Cr2O7的废液反应的离子方程式为
(5)从Cr2(SO4)3溶液制取Cr2(SO4)3•6H2O晶体的实验操作方法为
(6)已知Cr(OH)3化学性质与Al(OH)3类似,选择合适的化学试剂,将流程中的Cr2(SO4)3溶液转化为可用于陶瓷和搪瓷的着色剂Cr2O3(绿色粉末,广泛用于陶瓷和搪瓷的着色剂),转化过程中发生的主要的化学方程式为:
您最近一年使用:0次
名校
解题方法
10 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
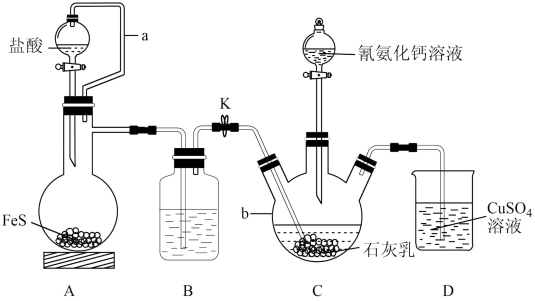
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为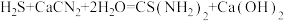 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵( )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
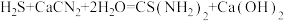 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
461次组卷
|
3卷引用:湖北省九师联盟2022届高三 三模考试化学试题