解题方法
1 . I.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:
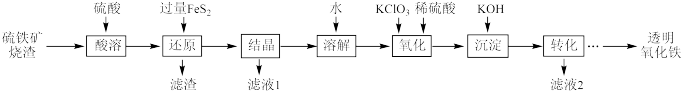
已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为___________ 。
(2)“滤渣”中的主要成分是___________ 。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)流程中“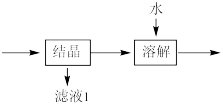 ”环节的目的是
”环节的目的是___________ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以___________ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:
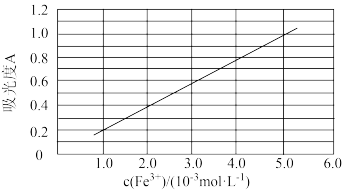
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为___________ %(保留小数点后一位)。
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:
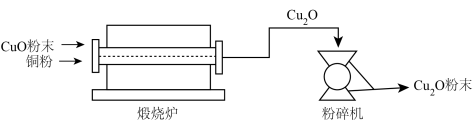
(7)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)“还原”过程中涉及的离子方程式为
(4)流程中“
 ”环节的目的是
”环节的目的是(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(7)粉碎机中,发生的变化属于
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 某溶液中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
某同学欲探究溶液的组成,进行了如下实验:
①用仪器a蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入适量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仪器a的名称是___________ 。
(2)③中加入适量盐酸生成无色气体的离子方程式是___________ 。
实验室制备红棕色气体时采用的收集方式为___________ 。
(3)无色气体与O2按照一定比例通入水中可被完全吸收,请写出该反应的化学方程式___________ 。
(4)该同学最终确定原溶液中所含阴离子是___________ ,阳离子是___________ (写离子符号)。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为___________ g。
| 阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、 、 、 、 、 、 、 |
①用仪器a蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入适量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仪器a的名称是
(2)③中加入适量盐酸生成无色气体的离子方程式是
实验室制备红棕色气体时采用的收集方式为
(3)无色气体与O2按照一定比例通入水中可被完全吸收,请写出该反应的化学方程式
(4)该同学最终确定原溶液中所含阴离子是
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
您最近一年使用:0次
名校
解题方法
3 . 化学在医学上起到至关重要的作用。如:小苏打、氢氧化铝等可治疗胃酸(主要成分为稀盐酸)过多;硫酸亚铁可补铁、防治贫血;三价铬用于加强胰岛素的作用。试回答下列问题:
(1)写出小苏打与胃酸作用的离子方程式:_______ ,但该药剂缺点是易导致胃胀气,胃溃疡患者不能使用,而氢氧化铝很好的解决了这个问题,它在中和胃酸的同时,保护溃疡面,写出氢氧化铝与胃酸作用的化学方程式为_______ 。
(2)利用提供试剂设计实验证明补铁剂中铁元素都以+2存在(可选试剂:硫氰化钾、过氧化氢):_______ (填写实验操作、现象和结论)。
(3)三价铬是人体必需的微量元素,六价铬则严重危害人体健康,铬元素化合价循环示意图如下【已知: 可溶于水;
可溶于水; 难溶于水】:
难溶于水】:
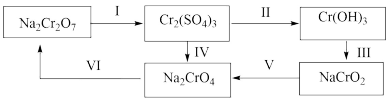
①步骤I所用的试剂是硫酸酸化的 ,请写出该反应的离子方程式;
,请写出该反应的离子方程式;_______
②现有含 和
和 的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是
的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是_______ 、_______ ;
③向50mL0.03mol/L的 溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式_______ 。
(1)写出小苏打与胃酸作用的离子方程式:
(2)利用提供试剂设计实验证明补铁剂中铁元素都以+2存在(可选试剂:硫氰化钾、过氧化氢):
(3)三价铬是人体必需的微量元素,六价铬则严重危害人体健康,铬元素化合价循环示意图如下【已知:
 可溶于水;
可溶于水; 难溶于水】:
难溶于水】:
①步骤I所用的试剂是硫酸酸化的
 ,请写出该反应的离子方程式;
,请写出该反应的离子方程式;②现有含
 和
和 的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是
的溶液,逐滴滴加NaOH溶液至过量,由上图信息可知,铁元素、铬元素的存在形态分别是③向50mL0.03mol/L的
 溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
溶液中,加入50mL0.2mol/L的NaOH溶液,写出相应离子反应方程式
您最近一年使用:0次
2023-01-12更新
|
426次组卷
|
2卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
名校
解题方法
4 . 某工厂的工业废水中含有大量的 和较多的
和较多的 。为减少污染并变废为宝,工厂计划从该废水中回收金属铜,并制备
。为减少污染并变废为宝,工厂计划从该废水中回收金属铜,并制备 ,流程如下:
,流程如下:
 和较多的
和较多的 。为减少污染并变废为宝,工厂计划从该废水中回收金属铜,并制备
。为减少污染并变废为宝,工厂计划从该废水中回收金属铜,并制备 ,流程如下:
,流程如下: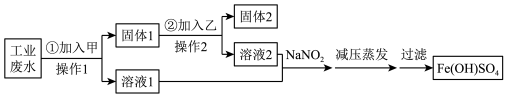
A.甲为铁粉,乙为 溶液 溶液 |
| B.操作1和操作2均用到漏斗、烧杯和玻璃棒,且固体2为铜 |
C.往溶液1与溶液2中加入 反应生成NO,欲制备1.5mol 反应生成NO,欲制备1.5mol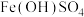 ,理论上至少需要2mol ,理论上至少需要2mol |
D.为检验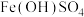 中是否含有 中是否含有 ,加入盐酸溶解,再加入过量NaOH溶液,观察沉淀颜色变化 ,加入盐酸溶解,再加入过量NaOH溶液,观察沉淀颜色变化 |
您最近一年使用:0次
2023-01-12更新
|
418次组卷
|
4卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
名校
解题方法
5 . 下列表示对应化学反应的离子方程式正确的是
A. 加入过量的 加入过量的 溶液: 溶液: |
B.向 溶液中加少量的 溶液中加少量的 溶液: 溶液: |
C.将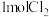 通入到含 通入到含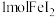 的溶液: 的溶液: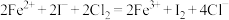 |
D. 溶液与 溶液与 溶液等体积混合: 溶液等体积混合: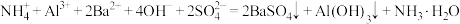 |
您最近一年使用:0次
6 . 以氟硅酸(制磷肥副产品)和电石灰为原料制备四氟化硅的一种工艺流程如图。已知电石灰主要成分为Ca(OH)2,还含有Al2O3、Fe2O3和SiO2等杂质。
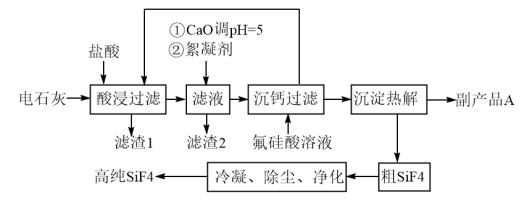
请回答下列问题:
(1)硅的某种核素含有16个中子,则该核素符号为___ 。沉钙过程中所加氟硅酸(H2SiF6)中硅元素的化合价为___ 。
(2)滤渣1的主要成分为___ (填化学式)。
(3)加入絮凝剂的目的为___ 。
(4)为检验“沉钙过滤”过程后的滤液中是否含有Fe3+,可选用的化学试剂是___ 。
(5)副产品A的化学式为___ ,上述流程中循环利用的物质为___ 。
(6)工业上可用碳酸钠溶液吸收SiF4,生成原硅酸(H4SiO4)和氟硅酸盐两种沉淀,写出该过程的化学方程式___ 。
(7)往CaCO3悬浊液中通入HF气体,也可以制得副产品A,写出该反应的离子反应方程式:___ 。(已知:25℃时,H2CO3的Ka1=4.5×10-7,Ka2=4.7×10-11;HF的Ka=6.3×10-4;Ksp(CaCO3)=3.4×10-9;Ksp(CaF2)=1.7×10-10)

请回答下列问题:
(1)硅的某种核素含有16个中子,则该核素符号为
(2)滤渣1的主要成分为
(3)加入絮凝剂的目的为
(4)为检验“沉钙过滤”过程后的滤液中是否含有Fe3+,可选用的化学试剂是
(5)副产品A的化学式为
(6)工业上可用碳酸钠溶液吸收SiF4,生成原硅酸(H4SiO4)和氟硅酸盐两种沉淀,写出该过程的化学方程式
(7)往CaCO3悬浊液中通入HF气体,也可以制得副产品A,写出该反应的离子反应方程式:
您最近一年使用:0次
名校
解题方法
7 . 某化学兴趣小组在学习铁及其化合物知识时,做了如下探究实验:
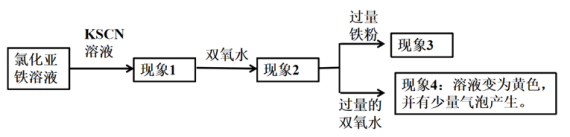
下列说法不正确 的是

下列说法
| A.若现象1有淡红色,说明有少量的Fe2+被氧化了 |
| B.现象2有血红色沉淀 |
| C.现象3为血红色褪去,说明发生了反应:2Fe3++Fe =3Fe2+ |
| D.由现象4可推测加入过量的双氧水后硫氰根离子可能被氧化生成了气体 |
您最近一年使用:0次
2021-01-30更新
|
468次组卷
|
6卷引用:重庆市2022-2023学年高一下学期6月月考化学试题
重庆市2022-2023学年高一下学期6月月考化学试题浙江省嘉兴市2020-2021学年高一上学期期末测试化学试题(已下线)【浙江新东方】在线化学60高一下(已下线)【浙江新东方】在线化学52高一上浙江之江教育评价2020-2021学年高一下学期期中联考化学试题浙江省乐清市知临中学2022-2023学年高一上学期期中考试化学试题(B)



