解题方法
1 . 下列反应的离子方程式书写正确的是
A.碳酸钡与盐酸反应:CO +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
| B.氯化铁溶液遇到硫氰化钾溶液显紫色:Fe3++3SCN-=Fe(SCN)3↓ |
C.NaHSO4溶液中加入Ba(OH)2溶液后溶液恰好显中性:Ba2++OH-+H++SO =BaSO4↓+H2O =BaSO4↓+H2O |
D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
您最近一年使用:0次
解题方法
2 .  是一种常见的市售补血药剂,与砂糖混用效果更佳,实验室模拟制备
是一种常见的市售补血药剂,与砂糖混用效果更佳,实验室模拟制备 并探究其性质如下:
并探究其性质如下:
(1)实验室制备 :
:
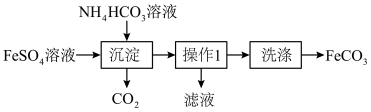
操作1为_______ ,写出生成沉淀的化学方程式:_______ 。
(2)探究 高温下煅烧产物:
高温下煅烧产物:
根据上述结论得到化学方程式:_______ 。
①实验步骤Ⅲ中溶液变红的离子方程式为_______ 。
②某同学提出了不同的看法:煅烧产物可能是 ,因为
,因为 也可以溶于硫酸,且所得溶液中也含有
也可以溶于硫酸,且所得溶液中也含有 。于是该同学对实验步骤Ⅱ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后
。于是该同学对实验步骤Ⅱ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后_______ (填字母)。
A.滴加氯水 B.滴加 溶液
溶液
C.先滴加 溶液后滴加氯水 D.滴加酸性
溶液后滴加氯水 D.滴加酸性 溶液
溶液
③有同学认为即使得到该同学预期的实验现象,也不能确定煅烧产物中含有+2价铁元素。于是他重新设计了由 制备
制备 的方案。先向
的方案。先向 粉末中依次加入试剂:稀硫酸、双氧水、氢氧化钠溶液;然后再过滤、洗涤、灼烧即可得到
粉末中依次加入试剂:稀硫酸、双氧水、氢氧化钠溶液;然后再过滤、洗涤、灼烧即可得到 。请写出和双氧水有关的离子方程式:
。请写出和双氧水有关的离子方程式:_______ 。
(3)产品纯度测定:(已知: 为常见氧化剂,酸性条件下的还原产物为
为常见氧化剂,酸性条件下的还原产物为 ;
; 取实验室制备产品
取实验室制备产品 20.00g于一洁净的大试管中,用足量的稀硫酸溶解,滴加几滴
20.00g于一洁净的大试管中,用足量的稀硫酸溶解,滴加几滴 溶液,再滴加
溶液,再滴加 的
的 溶液,当滴加48.00mL时,溶液恰好变为红色,则产品纯度为
溶液,当滴加48.00mL时,溶液恰好变为红色,则产品纯度为_______ 。
 是一种常见的市售补血药剂,与砂糖混用效果更佳,实验室模拟制备
是一种常见的市售补血药剂,与砂糖混用效果更佳,实验室模拟制备 并探究其性质如下:
并探究其性质如下:(1)实验室制备
 :
:
操作1为
(2)探究
 高温下煅烧产物:
高温下煅烧产物:| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的 固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加 溶液,溶液变红 溶液,溶液变红 |
| Ⅳ | 结论: 高温下煅烧产物为 高温下煅烧产物为 |
根据上述结论得到化学方程式:
①实验步骤Ⅲ中溶液变红的离子方程式为
②某同学提出了不同的看法:煅烧产物可能是
 ,因为
,因为 也可以溶于硫酸,且所得溶液中也含有
也可以溶于硫酸,且所得溶液中也含有 。于是该同学对实验步骤Ⅱ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后
。于是该同学对实验步骤Ⅱ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后A.滴加氯水 B.滴加
 溶液
溶液C.先滴加
 溶液后滴加氯水 D.滴加酸性
溶液后滴加氯水 D.滴加酸性 溶液
溶液③有同学认为即使得到该同学预期的实验现象,也不能确定煅烧产物中含有+2价铁元素。于是他重新设计了由
 制备
制备 的方案。先向
的方案。先向 粉末中依次加入试剂:稀硫酸、双氧水、氢氧化钠溶液;然后再过滤、洗涤、灼烧即可得到
粉末中依次加入试剂:稀硫酸、双氧水、氢氧化钠溶液;然后再过滤、洗涤、灼烧即可得到 。请写出和双氧水有关的离子方程式:
。请写出和双氧水有关的离子方程式:(3)产品纯度测定:(已知:
 为常见氧化剂,酸性条件下的还原产物为
为常见氧化剂,酸性条件下的还原产物为 ;
; 取实验室制备产品
取实验室制备产品 20.00g于一洁净的大试管中,用足量的稀硫酸溶解,滴加几滴
20.00g于一洁净的大试管中,用足量的稀硫酸溶解,滴加几滴 溶液,再滴加
溶液,再滴加 的
的 溶液,当滴加48.00mL时,溶液恰好变为红色,则产品纯度为
溶液,当滴加48.00mL时,溶液恰好变为红色,则产品纯度为
您最近一年使用:0次
名校
3 . 电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。为改善环境,废物利用,可从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜并使腐蚀液再生。处理流程如图:
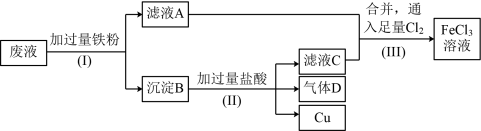
(1)检验废液中是否含有Fe3+所需要的试剂为_____ 。
(2)沉淀B中含有_____ 。
(3)步骤(I)中发生的离子反应方程式有(按反应顺序写出):_____ 。
(4)取少量滤液A于试管中,滴加NaOH溶液,现象是_____ 。
(5)步骤(Ⅲ)中,将氯气换成H2O2也能达到同样的目的。写出H2O2将Fe2+氧化为Fe3+的离子方程式:_____ 。

(1)检验废液中是否含有Fe3+所需要的试剂为
(2)沉淀B中含有
(3)步骤(I)中发生的离子反应方程式有(按反应顺序写出):
(4)取少量滤液A于试管中,滴加NaOH溶液,现象是
(5)步骤(Ⅲ)中,将氯气换成H2O2也能达到同样的目的。写出H2O2将Fe2+氧化为Fe3+的离子方程式:
您最近一年使用:0次
名校
4 . 下列离子方程式正确的是
| A.向CaCl2溶液中通入少量CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B.FeCl3溶液遇到KSCN溶液变为红色:Fe3++3SCN-=Fe(SCN)3↓ |
C.向氢氧化钡溶液中滴加硫酸氢钠溶液至中性:Ba2++2OH-+2H++SO =BaSO4↓+2H2O =BaSO4↓+2H2O |
| D.Cl2与水反应:Cl2+H2O=2H++Cl-+ClO- |
您最近一年使用:0次
2023-01-03更新
|
378次组卷
|
3卷引用:湖北省荆州中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 常温下,下列各组离子在指定的溶液中一定能大量共存的是
A.在加入铝产生氢气的溶液: 、 、 、 、 、 、 |
B.在 溶液中: 溶液中: 、 、 、 、 、 、 |
C.在碱性溶液中: 、 、 、 、 、 、 |
D.在透明溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
名校
解题方法
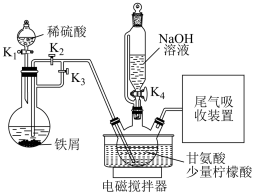
6 . 甘氨酸亚铁[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。实验室制备甘氨酸亚铁部分装置如下图(部分夹持装置省略,气密性已检查)。
ⅰ.2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
ⅱ.柠檬酸易溶于水和乙醇,有弱酸性和还原性。
ⅲ.(H2NCH2COO)2Fe易溶于水,难溶于乙醇。
下列说法错误的是
ⅰ.2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
ⅱ.柠檬酸易溶于水和乙醇,有弱酸性和还原性。
ⅲ.(H2NCH2COO)2Fe易溶于水,难溶于乙醇。
下列说法错误的是
| A.发生反应ⅰ的操作:先打开K1、K3,一段时间后关闭K1、K3,再打开K2、K4 |
| B.加入柠檬酸的作用是调节溶液的pH使反应充分发生 |
| C.反应结束后向反应混合液中加入乙醇,目的是降低甘氨酸亚铁的溶解度 |
| D.洗涤甘氨酸亚铁粗产品最好选择乙醇 |
您最近一年使用:0次
2022-12-26更新
|
225次组卷
|
5卷引用:湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题
湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题湖北省武汉市第三中学2023-2024学年高一上学期12月月考化学试卷(已下线)T13-化学实验基础(已下线)选择题11-15山西省运城市2021-2022学年高三上学期期中考试化学试题
解题方法
7 . 下列物质既可通过化合反应,又可通过置换反应制得的是
| A.FeCl2 | B.FeCl3 | C.Fe3O4 | D.Na2O2 |
您最近一年使用:0次
8 . 用KSCN溶液和FeCl2溶液探究 的还原性时出现异常现象实验如下:不正确的是
的还原性时出现异常现象实验如下:不正确的是
 的还原性时出现异常现象实验如下:不正确的是
的还原性时出现异常现象实验如下:不正确的是| ① | ② | ③ |
 |  |  |
溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和 溶液,产生白色沉淀 溶液,产生白色沉淀 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和 溶液,无白色沉淀,经检验无丁达尔效应。 溶液,无白色沉淀,经检验无丁达尔效应。 |
A.对比①③,可判定酸性条件下 可氧化 可氧化 |
B.实验 中发生的氧化还原反应有两种 中发生的氧化还原反应有两种 |
C.②中红色溶液中含有 胶体 胶体 |
D.③中发生的氧化还原反应为: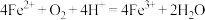 |
您最近一年使用:0次
2022-12-19更新
|
424次组卷
|
3卷引用:湖北省十堰市第二中学2021-2022学年高一上学期12月考试化学试题
名校
9 . 下列有关实验、现象、及结论等叙述正确的有( )
①向溶有 的
的 溶液中通入气体X,出现白色沉淀,X具有强氧化性
溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸有白色沉淀产生,该溶液中一定含有钡离子
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有
⑤向饱和 溶液中滴加硼酸,无气泡产生,非金属性:硼<碳
溶液中滴加硼酸,无气泡产生,非金属性:硼<碳
⑥取少量 样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
①向溶有
 的
的 溶液中通入气体X,出现白色沉淀,X具有强氧化性
溶液中通入气体X,出现白色沉淀,X具有强氧化性②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸有白色沉淀产生,该溶液中一定含有钡离子
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有

⑤向饱和
 溶液中滴加硼酸,无气泡产生,非金属性:硼<碳
溶液中滴加硼酸,无气泡产生,非金属性:硼<碳⑥取少量
 样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质| A.1条 | B.0条 | C.3条 | D.4条 |
您最近一年使用:0次
2022-12-15更新
|
1193次组卷
|
4卷引用:湖北省武汉市第六中学2022-2023学年高一上学期第三次月考化学试题
解题方法
10 . 实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为mg的生铁粉末样品,分别进行如图实验。
I.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为_______ ,所需的玻璃仪器有_______ 。
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为_______ ,检验硫酸铁溶液中Fe3+存在的试剂是_______ 。
II.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C 4Fe+3 CO2↑
4Fe+3 CO2↑
②Fe2O3+3H2 2Fe+3H2O↑。
2Fe+3H2O↑。
如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。
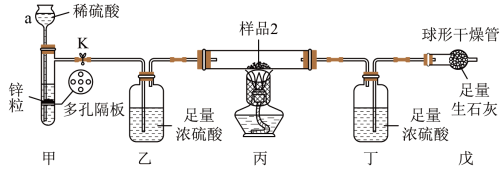
(3)仪器a的名称为_______ 。
(4)若无装置乙,会导致测得氧化铁的质量分数_______ (填“偏大”“偏小”或“不变”)。
(5)装置戊的作用为:_______ 。
(6)原样品中氧化铁的质量为_______ 。
I.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为
II.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C
 4Fe+3 CO2↑
4Fe+3 CO2↑②Fe2O3+3H2
 2Fe+3H2O↑。
2Fe+3H2O↑。如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。

(3)仪器a的名称为
(4)若无装置乙,会导致测得氧化铁的质量分数
(5)装置戊的作用为:
(6)原样品中氧化铁的质量为
您最近一年使用:0次



