1 . 下列有关物质的性质与用途不具有对应关系的是
| A.干冰升华时吸热,可用作人工降雨 |
B. 吸收 吸收 产生 产生 ,可用作呼吸面具供氧剂 ,可用作呼吸面具供氧剂 |
C. 溶液显酸性,可蚀刻印刷电路板上的Cu 溶液显酸性,可蚀刻印刷电路板上的Cu |
D. 固体受热分解产生 固体受热分解产生 ,可用作膨松剂 ,可用作膨松剂 |
您最近一年使用:0次
名校
解题方法
2 . 下列有关物质的性质与用途不具有对应关系的是
| A.干冰升华时吸热,可用作人工降雨 |
| B.维生素C具有还原性,可用作食品抗氧化剂 |
C. 溶液显酸性,可蚀刻印刷电路板上的Cu 溶液显酸性,可蚀刻印刷电路板上的Cu |
D. 固体受热分解产生 固体受热分解产生 ,可用作膨松剂 ,可用作膨松剂 |
您最近一年使用:0次
2023-08-22更新
|
255次组卷
|
3卷引用:贵州省贵阳市2024届高三上学期开学考试化学试题
名校
解题方法
3 . 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图:

实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。
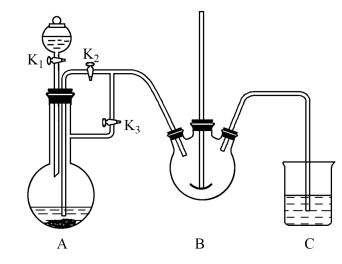
回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是___________ 。
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭___________ ,打开___________ (填“K1”、“K2”或“K3”);装置B中生成FeCO3的离子方程式为___________ 。
(3)转化过程中温度不超过35℃,主要原因是___________ ;“过滤”环节,不需要使用下列仪器中的___________ (填仪器名称)。

(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为___________ ;检验产品中是否含Fe3+需要的试剂有稀H2SO4和___________ (填化学式)。
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为___________ %(计算结果取整数)。

实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。

回答下列问题:
(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是
(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭
(3)转化过程中温度不超过35℃,主要原因是

(4)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为
您最近一年使用:0次
2022-03-22更新
|
615次组卷
|
2卷引用:贵州省贵阳市2022届高三一模理综化学试卷
解题方法
4 . 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
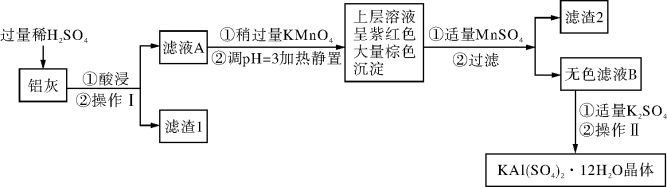
回答下列问题:
(1)明矾净水的原理是___________ (用离子方程式表示)。
(2)操作Ⅰ是___________ ,滤液B中K+焰色反应颜色为:___________ 。
(3)检验滤液A中是否存在Fe2+的试剂是___________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为___________ 。
已知:生成氢氧化物沉淀的pH如下表所示:
注:金属离子的起始浓度为0.1 mol·L-1。
根据表中数据解释调节pH=3的目的:___________ 。
(5)已知:在pH=3、加热条件下,MnO 可与Mn2+反应生成MnO2,加入MnSO4发生反应的离子方程式为:
可与Mn2+反应生成MnO2,加入MnSO4发生反应的离子方程式为:___________ 。滤渣2含有的物质是___________ 。

回答下列问题:
(1)明矾净水的原理是
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为
已知:生成氢氧化物沉淀的pH如下表所示:
| 物质 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1。
根据表中数据解释调节pH=3的目的:
(5)已知:在pH=3、加热条件下,MnO
 可与Mn2+反应生成MnO2,加入MnSO4发生反应的离子方程式为:
可与Mn2+反应生成MnO2,加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次
5 . 铁及其化合物在生产、生活中有重要用途。
(1)常温下,可用铁质容器盛放浓硫酸。原因是___ 。
(2)鉴别FeCl3溶液和Fe(OH)3胶体,除观察颜色外。还能用到的方法是__ 。
(3)Fe2+和Fe3+可以相互转化,若要证明溶液中的Fe2+被氧化生成了Fe3+,可选用的试剂是___ (填化学式)。
(4)保存1.6mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊。应调节溶液的pH不超过__ (已知:常温下,Ksp[Fe(OH)2]=1.6×10-16)
(5)在日常生活和生产中,钢铁的腐蚀普遍存在且危害较大。了解钢铁防离蚀的措施意义重大。利用如图所示装置可以模拟铁的电化学防护。其中Y为NaCl为减缓铁的腐蚀。

①着X为锌、开关K置于M处。这一保护方法叫做___ 。
②若X为碳棒、开关K置于N处,此时铁极为___ (填“阴极”或“阳极”),X极的电极反应式为__ 。
(1)常温下,可用铁质容器盛放浓硫酸。原因是
(2)鉴别FeCl3溶液和Fe(OH)3胶体,除观察颜色外。还能用到的方法是
(3)Fe2+和Fe3+可以相互转化,若要证明溶液中的Fe2+被氧化生成了Fe3+,可选用的试剂是
(4)保存1.6mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊。应调节溶液的pH不超过
(5)在日常生活和生产中,钢铁的腐蚀普遍存在且危害较大。了解钢铁防离蚀的措施意义重大。利用如图所示装置可以模拟铁的电化学防护。其中Y为NaCl为减缓铁的腐蚀。

①着X为锌、开关K置于M处。这一保护方法叫做
②若X为碳棒、开关K置于N处,此时铁极为
您最近一年使用:0次



