解题方法
1 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
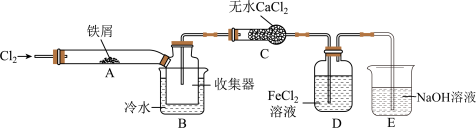
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近一年使用:0次
2 . 我国锰矿资源主要为贫碳酸锰矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。 ,
, 。
。
(1) 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。
(2)“滤渣1”的主要成分是___________ (填化学式)。
(3)“氧化”的目的是将 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ ,检测 是否完全氧化的试剂是
是否完全氧化的试剂是___________ (写试剂名称)。
(4)“除钙镁”后的滤液中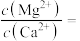
___________ 。
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因___________ 。
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是___________ ,为了获得 ,需要加热到
,需要加热到___________  (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。
 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。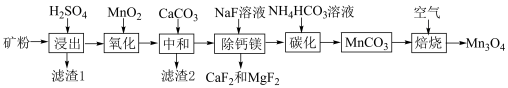
 ,
, 。
。(1)
 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。A.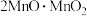 | B.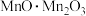 | C.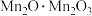 | D. |
(2)“滤渣1”的主要成分是
(3)“氧化”的目的是将
 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式 是否完全氧化的试剂是
是否完全氧化的试剂是(4)“除钙镁”后的滤液中
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是
 ,需要加热到
,需要加热到 (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。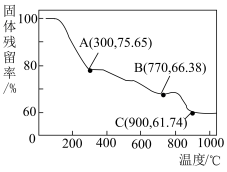
您最近一年使用:0次
2024-03-08更新
|
208次组卷
|
4卷引用:甘肃省张掖市某重点校2023-2024学年高三下学期模拟考化学试题
甘肃省张掖市某重点校2023-2024学年高三下学期模拟考化学试题(已下线)大题预测卷(黑龙江、吉林专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学陕西省西安工业大学附属中学2023-2024学年高三下学期3月月考理科综合试题-高中化学
3 . 利用如图所示装置进行铁跟水蒸气反应的实验,并对反应产物进行探究。
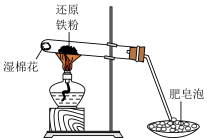
I.
(1)试管中发生反应的化学方程式为___________ 。
(2)实验中使用肥皂液的作用是___________ 。
Ⅱ.欲确定反应一段时间后试管中黑色物质X的成分,部分同学设计了如下方案:
(3)甲同学将少量X与足量硫酸铜溶液反应,固体部分溶解,有红色物质析出,过滤,除去滤渣中红色物质,向剩余滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过分析现象,甲同学得出X的组成是Fe和 。
。
若在X中直接加入盐酸和KSCN溶液,溶液不出现红色,原因是___________ 。
(4)乙同学的实验方案如下:

①加入 时,发生反应的离子方程式为
时,发生反应的离子方程式为___________ 。
②灼烧沉淀时必须用到下列实验仪器的是(填名称)___________ 。

③通过以上数据,可得出2.88g黑色物质X中 的物质的量为
的物质的量为___________ 。
(5)丙同学将试管内固体看做铁的氧化物( ),取出6.08g溶于足量盐酸中,向所得溶液中通入
),取出6.08g溶于足量盐酸中,向所得溶液中通入 (标准状况),恰好将Fe元素完全氧化为
(标准状况),恰好将Fe元素完全氧化为 ,则x=
,则x=___________ 。

I.
(1)试管中发生反应的化学方程式为
(2)实验中使用肥皂液的作用是
Ⅱ.欲确定反应一段时间后试管中黑色物质X的成分,部分同学设计了如下方案:
(3)甲同学将少量X与足量硫酸铜溶液反应,固体部分溶解,有红色物质析出,过滤,除去滤渣中红色物质,向剩余滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过分析现象,甲同学得出X的组成是Fe和
 。
。若在X中直接加入盐酸和KSCN溶液,溶液不出现红色,原因是
(4)乙同学的实验方案如下:

①加入
 时,发生反应的离子方程式为
时,发生反应的离子方程式为②灼烧沉淀时必须用到下列实验仪器的是(填名称)

③通过以上数据,可得出2.88g黑色物质X中
 的物质的量为
的物质的量为(5)丙同学将试管内固体看做铁的氧化物(
 ),取出6.08g溶于足量盐酸中,向所得溶液中通入
),取出6.08g溶于足量盐酸中,向所得溶液中通入 (标准状况),恰好将Fe元素完全氧化为
(标准状况),恰好将Fe元素完全氧化为 ,则x=
,则x=
您最近一年使用:0次
名校
4 . 写出下列反应的方程式:
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式___________ 。
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式___________ 。
(3)漂白粉在空气中生效的化学方程式___________ 。
(4)请写出次氯酸光照分解的离子方程式___________ 。
(5) 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式______ 。
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式
(3)漂白粉在空气中生效的化学方程式
(4)请写出次氯酸光照分解的离子方程式
(5)
 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式
您最近一年使用:0次
23-24高三上·贵州遵义·阶段练习
5 . 下列实验的操作、现象和结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 探究铁粉在氯气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2~3mL蒸馏水,振荡,迅速滴入几滴KSCN溶液,溶液不显红色 | 该固体粉末中不存在FeCl3 |
| B | 证明SO2具有漂白性 | 将SO2缓慢通入滴有酚酞的NaOH溶液中,溶液红色褪去 | SO2有漂白性 |
| C | 探究温度对化学平衡的影响 | 加热盛有CuCl2溶液的试管,溶液变为黄色,冷却后变为蓝色 | [Cu(H2O)4]2+转化为[CuCl4]2-的反应放热 |
| D | 探究Cl2的性质 | 将Cl2通入K2S溶液中,生成淡黄色沉淀 | Cl2具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
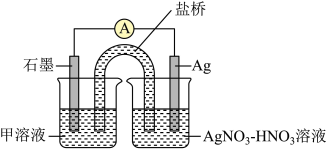
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
609次组卷
|
7卷引用:甘肃省部分校2024届高三上学期10月月考化学试题
名校
7 . 将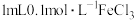 溶液与
溶液与 混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴
混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴 试液、
试液、 溶液、淀粉试液、
溶液、淀粉试液、 溶液,其中能较好地证明
溶液,其中能较好地证明 与
与 之间发生了反应且为可逆反应的实验是
之间发生了反应且为可逆反应的实验是
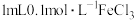 溶液与
溶液与 混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴
混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴 试液、
试液、 溶液、淀粉试液、
溶液、淀粉试液、 溶液,其中能较好地证明
溶液,其中能较好地证明 与
与 之间发生了反应且为可逆反应的实验是
之间发生了反应且为可逆反应的实验是| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2023-09-26更新
|
200次组卷
|
3卷引用:甘肃省天祝藏族自治县第一中学2023-2024学年高二上学期9月月考化学试题
8 . 去除空气中SO2的污染,科研人员设计了碘循环工艺。副产品为氢气,具体流程如下:
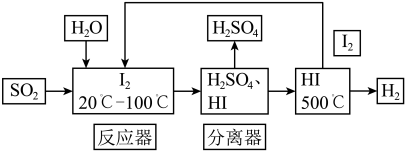
(56.9%的HI水溶液恒沸点127℃,98.3%H2SO4水溶液恒沸点338℃)
回答下列问题:
(1)写出反应器中发生反应的化学方程式_______ 。
(2)取样,检验反应器中碘单质是否消耗完全,应加入的试剂为_______ 。
(3)分离器中的物质分离操作为_______ 。
(4)该循环工艺的总反应化学方程式为_______ 。
(5)在溶液中铁离子可以将碘离子氧化为碘单质,该反应的离子方程式为_______ 。请设计出该反应发生后检验溶液中是否存在铁离子的实验方案_______ 。
(6)500℃分解HI生成碘蒸汽和氢气,利用冷却时碘_______ 可以将二者进行分离。

(56.9%的HI水溶液恒沸点127℃,98.3%H2SO4水溶液恒沸点338℃)
回答下列问题:
(1)写出反应器中发生反应的化学方程式
(2)取样,检验反应器中碘单质是否消耗完全,应加入的试剂为
(3)分离器中的物质分离操作为
(4)该循环工艺的总反应化学方程式为
(5)在溶液中铁离子可以将碘离子氧化为碘单质,该反应的离子方程式为
(6)500℃分解HI生成碘蒸汽和氢气,利用冷却时碘
您最近一年使用:0次
2023-07-12更新
|
68次组卷
|
3卷引用:甘肃省兰州市等5地2022-2023学年高一下学期期末化学试题
名校
9 . 已知 为无色离子。验证
为无色离子。验证 转化为
转化为 的实验操作和实验现象如下:
的实验操作和实验现象如下:
下列分析不合理 的是
 为无色离子。验证
为无色离子。验证 转化为
转化为 的实验操作和实验现象如下:
的实验操作和实验现象如下:| 实验操作 | 实验现象 |
①向 溶液中加入锌粉至 溶液中加入锌粉至 恰好转化为 恰好转化为 ②滴加  溶液 溶液 | I.溶液由黄色变成浅绿色 II.溶液无明显变化 |
A.解释现象I的反应: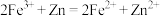 |
| B.若步骤②改为滴入少量氨水,则对应的现象是立即产生红褐色沉淀 |
C.若步骤①中 溶液与锌粉反应后还有锌粉剩余,则对应的现象是溶液由黄色变成无色 溶液与锌粉反应后还有锌粉剩余,则对应的现象是溶液由黄色变成无色 |
D.还原性: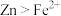 |
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
| A.通过焰色试验,观察到火焰呈黄色,则溶液中一定有Na+,可能有K+ |
| B.焰色试验前将铂丝用稀硫酸清洗,并灼烧至火焰与原来颜色相同 |
| C.向久置的FeCl2溶液中滴加酸性KMnO4溶液,紫色褪去,说明FeCl2未完全变质 |
| D.向溶液中先通入Cl2,再加入KSCN溶液,溶液变红,说明溶液中存在Fe2+ |
您最近一年使用:0次
2023-02-11更新
|
171次组卷
|
2卷引用:甘肃省兰州第一中学2022-2023学年高一上学期期末考试化学试题



