1 . 我国锰矿资源主要为贫碳酸锰矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。 ,
, 。
。
(1) 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。
(2)“滤渣1”的主要成分是___________ (填化学式)。
(3)“氧化”的目的是将 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ ,检测 是否完全氧化的试剂是
是否完全氧化的试剂是___________ (写试剂名称)。
(4)“除钙镁”后的滤液中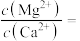
___________ 。
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因___________ 。
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是___________ ,为了获得 ,需要加热到
,需要加热到___________  (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。
 ,还含有少量
,还含有少量 、
、 、
、 、
、 、
、 、
、 ),利用贫碳酸锰矿制取
),利用贫碳酸锰矿制取 的流程如图所示,回答下列问题。
的流程如图所示,回答下列问题。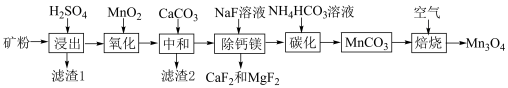
 ,
, 。
。(1)
 中锰元素的价态有+2价和+3价,则下列表示
中锰元素的价态有+2价和+3价,则下列表示 组成的式子正确的是___________(填标号)。
组成的式子正确的是___________(填标号)。A.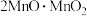 | B.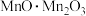 | C.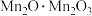 | D. |
(2)“滤渣1”的主要成分是
(3)“氧化”的目的是将
 转化为
转化为 ,写出发生反应的离子方程式
,写出发生反应的离子方程式 是否完全氧化的试剂是
是否完全氧化的试剂是(4)“除钙镁”后的滤液中
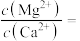
(5)“碳化”过程需要加热,但温度不能太高,试分析温度不能太高的原因
(6)“焙烧”过程中随温度不同生成的锰的氧化物也不同。图中A点对应的氧化物是
 ,需要加热到
,需要加热到 (已知:A、B、C三点对应的物质均为纯净氧化物)。
(已知:A、B、C三点对应的物质均为纯净氧化物)。
您最近一年使用:0次
2024-03-08更新
|
208次组卷
|
4卷引用:大题预测卷(黑龙江、吉林专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
(已下线)大题预测卷(黑龙江、吉林专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)甘肃省张掖市某重点校2023-2024学年高三下学期模拟考化学试题陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学陕西省西安工业大学附属中学2023-2024学年高三下学期3月月考理科综合试题-高中化学
名校
2 . 超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如下:

资料:①含银废催化剂成分:主要含 、
、 及少量
及少量 、
、 、
、 、
、 等。
等。
② 为载体,且不溶于硝酸。
为载体,且不溶于硝酸。
下列说法错误的是

资料:①含银废催化剂成分:主要含
 、
、 及少量
及少量 、
、 、
、 、
、 等。
等。②
 为载体,且不溶于硝酸。
为载体,且不溶于硝酸。下列说法错误的是
A.过程I中,得到的滤渣的主要成分是: 、 、 |
B.过程Ⅱ中,检验沉淀表面的 已洗涤干净的试剂可以用KSCN溶液 已洗涤干净的试剂可以用KSCN溶液 |
| C.过程Ⅳ中,发生反应的氧化剂和还原剂物质的量之比为1:4 |
| D.过程Ⅴ可以利用电能转化为化学能的装置去实现 |
您最近一年使用:0次
2023-07-29更新
|
1355次组卷
|
6卷引用:吉林省长春市东北师范大学附属中学2023-2024学年高三上学期9月一模化学试题
吉林省长春市东北师范大学附属中学2023-2024学年高三上学期9月一模化学试题河北省保定市2022-2023学年高三上学期1月期末考试化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省六安第一中学2023-2024学年高三上学期12月月考化学试题福建省莆田第六中学2023-2024学年高三上学期1月质检模拟考化学试题福建省福清西山学校2023-2024学年高三上学期12月月考化学试题
解题方法
3 . 如图是铁及其化合物的“价—类”二维图,下列有关叙述正确的是
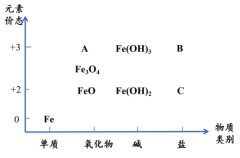

| A.Fe3O4为磁铁矿的主要成分,其中铁元素的化合价为+3价 |
| B.可用酸性KMnO4溶液检验C中阳离子 |
| C.A为黑色晶体,常用于涂料的生产 |
| D.C转化为B的反应类型为复分解反应 |
您最近一年使用:0次
4 . 下列说法正确的是
| A.H2O2溶液中加入少量MnO2粉末生成H2和O2 |
| B.金属钠着火时,可用水来灭火 |
| C.Mg加入到过量FeCl3溶液中可得Fe |
| D.观察钾及其化合物的焰色反应需要透过蓝色钴玻璃 |
您最近一年使用:0次
名校
解题方法
5 . 铁是人类较早使用的金属之一,FeSO4和FeCl3是重要的化工原料。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量_______ (填标号,下同);向FeSO4溶液加入_______ 可验证该溶液是否变质。
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是_______ 。(已知:Fe2+遇铁氰化钾溶液产生蓝色沉淀)
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:
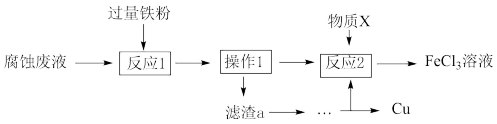
①滤渣a为_______ 。
②物质X为_______ 。
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是_______
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为_______ 。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣a为
②物质X为
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为
您最近一年使用:0次
2023-02-14更新
|
296次组卷
|
3卷引用:吉林省长春外国语学校2023-2024学年高一下学期开学化学试题
6 . 某固体W溶于稀硫酸后,将溶液分成两份,一份溶液中加入酸性高锰酸钾溶液,溶液紫红色变浅;另一份溶液中加入KSCN溶液,溶液变红色。由此可推知,W可能是
A. | B.FeO | C. | D. |
您最近一年使用:0次
名校
解题方法
7 . 向500mL含等物质的量的FeCl3和FeCl2混合溶液中加入一定量锌粉,反应过程过程中各离子的物质的量与加入锌粉的物质的量关系如图所示。
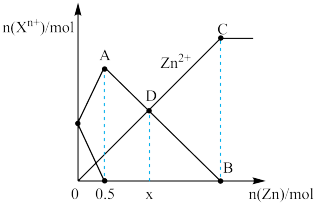
下列说法中正确的是

下列说法中正确的是
| A.线段AB表示溶液中n(Fe3+)的变化趋势 |
| B.起始时,FeCl3溶液和FeCl2溶液的物质的量浓度均为1mol/L |
| C.D点的横坐标x=1.5mol |
| D.反应至B点时,溶液总质量增加50.5g |
您最近一年使用:0次
2022-12-10更新
|
859次组卷
|
7卷引用:吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题
8 . 铝土矿中的主要成分是Al2O3,还含有少量Fe2O3等杂质。工业上从铝土矿中提取铝的工艺流程如下图所示。
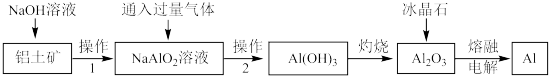
请回答下列问题
(1)“操作1”“操作2”相同,操作的名称为_______ ,实验室进行此项操除使用烧杯外还要使用的玻璃仪器有_______ 。
(2)向 溶液中通入了一种过量气体,这种气体是下列中的
溶液中通入了一种过量气体,这种气体是下列中的_______ (填字母)。
a.HCl b.NH3 c.CO2 d.O2
(3)冶炼铝需要纯度较高的氧化铝,检验得到的氧化铝中不含Fe2O3的化学方法是_______ 。
(4)写出电解熔融氧化铝的方程式_______ 。
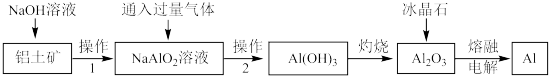
请回答下列问题
(1)“操作1”“操作2”相同,操作的名称为
(2)向
 溶液中通入了一种过量气体,这种气体是下列中的
溶液中通入了一种过量气体,这种气体是下列中的a.HCl b.NH3 c.CO2 d.O2
(3)冶炼铝需要纯度较高的氧化铝,检验得到的氧化铝中不含Fe2O3的化学方法是
(4)写出电解熔融氧化铝的方程式
您最近一年使用:0次
名校
9 . 为了探究浓度和温度对平衡的影响,设计如下方案:
已知:

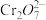 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H1
(黄色)+2H+ △H1
 (蓝色)+4Cl-
(蓝色)+4Cl-
 (黄色)+4H2O △H2
(黄色)+4H2O △H2
下列叙述正确的是
| 实验 | 操作 | 现象 |
| ① | 向1mL 0.05 mol∙L-1 FeCl3溶液中滴加1滴0.15 mol∙L-1 KSCN溶液 | 溶液变红色 |
| ② | 向1mL 0.05 mol∙L-1 FeCl3溶液中滴加1mL 0.5 mol∙L-1 NaF溶液,再滴1滴0.15 mol∙L-1 KSCN溶液 | 溶液不变红色 |
| ③ | 向1mL 0.1 mol∙L-1 K2Cr2O7溶液中滴加几滴浓硫酸 | 溶液橙色加深 |
| ④ | 将盛有1mL 0.5 mol∙L-1 CuCl2溶液的两支试管,分别置于热水浴和冷水浴中 | 前者溶液显黄色,后者溶液显蓝色 |

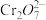 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H1
(黄色)+2H+ △H1 (蓝色)+4Cl-
(蓝色)+4Cl-
 (黄色)+4H2O △H2
(黄色)+4H2O △H2下列叙述正确的是
A.由①和②可知,Fe(SCN)3比 稳定 稳定 |
B.由③可知,c(H+)增大,平衡向生成 的方向移动 的方向移动 |
| C.由④可知,△H2<0 |
| D.由上述实验可知,向CuCl2溶液持续通入HCl,溶液蓝色加深 |
您最近一年使用:0次
2022-11-05更新
|
158次组卷
|
4卷引用:吉林省白山市抚松县第一中学2023-2024学年高二上学期11月月考化学试题
解题方法
10 . 某同学为了验证硫铁矿(主要成分为FeS2。含有少量的碳)焙烧产物(产生的气体是SO2,CO2),设计如下装置进行实验:
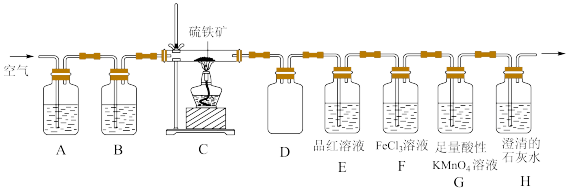
回答下列问题:
(1)装置A、B中的试剂分别是_______ 、_______ 。
(2)装置D的作用是_______ 。
(3)验证焙烧后气体产物的实验现象分别为_______ 、_______ ;若F中颜色发生改变,写出产生颜色变化反应的离子方程式:_______ 。取F中反应后的溶液于洁净的试管中。滴加少量KSCN溶液,溶液不变红,说明溶液中_______ (填“含有”或“不含有”)Fe3+;再继续滴加少量氯水,溶液也不变红。产生这种现象的原因可能是_______ 。
(4)G中盛放足量酸性KMnO4溶液的目的是_______ (用离子方程式表示)。
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:_______ 。

回答下列问题:
(1)装置A、B中的试剂分别是
(2)装置D的作用是
(3)验证焙烧后气体产物的实验现象分别为
(4)G中盛放足量酸性KMnO4溶液的目的是
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:
您最近一年使用:0次



