名校
解题方法
1 . 探究铁及其化合物的性质,下列实验方案、现象或结论不正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 2mL0.01mol·L-1FeCl3溶液滴加 浓盐酸 浓盐酸 | 溶液颜色变浅 | 氢离子抑制了Fe3+的水解 |
| B | 常温下,向 溶液中加入 溶液中加入 溶液,将带火星的木条放在试管口 溶液,将带火星的木条放在试管口 | 木条复燃 |  比 比 的氧化性强 的氧化性强 |
| C | 向氢氧化铁胶体中逐滴加入稀硫酸至过量 | 先产生沉淀后逐渐溶解 | Fe(OH)3先聚集为沉淀,后与 应 应 |
| D | 向K3Fe(CN)6溶液中加入少许铁粉,静置一段时间 | 有蓝色沉淀生成 | K3Fe(CN)6具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
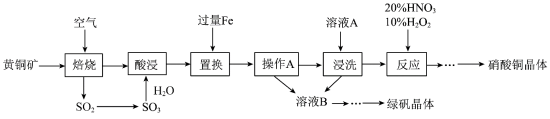
2 . 研究人员拟设计黄铜矿(主要含CuFeS2)制备硝酸铜和绿矾晶体的流程如下:
(1)CuFeS2中铁元素的化合价为___________ 价,已知“焙烧”生成SO2、CuO和Fe2O3,则其化学反应方程式为___________ 。
(2)“置换”步骤中发生的所有反应的离子方程式有___________ 、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑。
(3)流程中“操作 A”所需的玻璃仪器有_____________ 。
(4)“浸洗”步骤中加溶液A 的目的是_______________ 。
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:___________ 。
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为_______________ 。
(1)CuFeS2中铁元素的化合价为
(2)“置换”步骤中发生的所有反应的离子方程式有
(3)流程中“操作 A”所需的玻璃仪器有
(4)“浸洗”步骤中加溶液A 的目的是
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为
您最近一年使用:0次
22-23高一下·全国·期末
名校
解题方法
3 . 如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
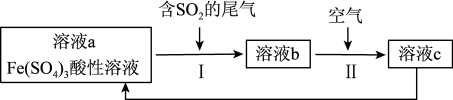
| A.操作Ⅱ发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O |
| B.溶液b中阳离子只有Fe2+ |
| C.溶液a转化为溶液b的反应中,SO2被还原 |
| D.加入FeO可以使溶液c转化为溶液a |
您最近一年使用:0次
2023-05-26更新
|
1115次组卷
|
8卷引用:江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题
江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题(已下线)期末模拟预测卷A-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)第14讲 硫和二氧化硫-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)湖南师大附中博才实验中学2022-2023年高一下学期期末考试化学试题广西南宁市第八中学2023-2024学年高二上学期开学考化学试题(已下线)猜想01 硫及其化合物的性质与转化(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)综合01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)(已下线)期末检测卷02-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
解题方法
4 . 下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将HI溶液加入Fe(NO3)3溶液中,充分反应后再加入CCl4混合振荡,静置 | 溶液分层, 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| B | 过量的铁粉和氯气反应,将反应后的固体溶于盐酸后,滴加KSCN溶液 | 溶液不显红色 | 过量铁与氯气反应的产物为FeCl2 |
| C | 室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2SO3溶液和CH3COONa溶液的pH | pH:Na2SO3>CH3COONa | H2SO3酸性弱于CH3COOH |
| D | 向2支装有等物质的量的AgCl、AgI的试管中分别滴加足量等体积等浓度的氨水 | AgCl溶解而AgI不溶解 | 相同温度下,Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 钒是一种重要的战略金属元素,被誉为“现代工业的维生素”。制备 的工艺流程图如下:
的工艺流程图如下:
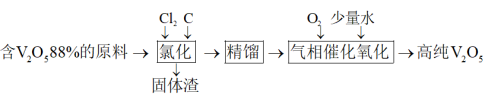
(1)“氯化”过程中反应温度控制在200℃左右,生成三氯氧钒( )和CO2,其化学方程式为
)和CO2,其化学方程式为___________ 。如果不加入碳,也能生成三氯氧钒( ),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能
),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能___________ 。
(2)在氯化过程中,不同杂质形成相应的氯化物进入粗三氯氧钒( )液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
)液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
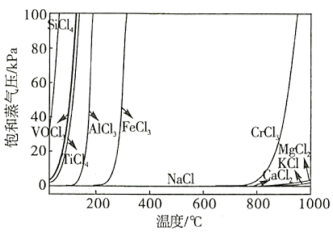
①从图中可以得出结论:挥发度( )
)___________ (填“大于”“小于”或“等于”挥发度( )
)
②经精馏后,三氯氧钒( )中主要含有的杂质为
)中主要含有的杂质为___________ 。
(3)气相催化氧化反应机理如下图所示:

①水解反应、氧化反应方程式分别为___________ 、___________ ;
②制备V2O5的工艺流程中循环使用的物质为___________ 。
(4)不同的工业设计,表现不同的特征。
①有研究人员在“氯化”过程中,控制适当的条件同时增加___________ 的用量,把V2O5转化成二氯氧钒( ),其优点是精馏后可以直接水解得到V2O5,原因是
),其优点是精馏后可以直接水解得到V2O5,原因是___________ ;
②利用含V2O588%的原料,采用湿法治金依次除去相关杂质,也可以得到V2O5,这种设计的缺点是___________ (写出一条)。
 的工艺流程图如下:
的工艺流程图如下:
(1)“氯化”过程中反应温度控制在200℃左右,生成三氯氧钒(
 )和CO2,其化学方程式为
)和CO2,其化学方程式为 ),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能
),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能(2)在氯化过程中,不同杂质形成相应的氯化物进入粗三氯氧钒(
 )液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
)液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
①从图中可以得出结论:挥发度(
 )
) )
)②经精馏后,三氯氧钒(
 )中主要含有的杂质为
)中主要含有的杂质为(3)气相催化氧化反应机理如下图所示:

①水解反应、氧化反应方程式分别为
②制备V2O5的工艺流程中循环使用的物质为
(4)不同的工业设计,表现不同的特征。
①有研究人员在“氯化”过程中,控制适当的条件同时增加
 ),其优点是精馏后可以直接水解得到V2O5,原因是
),其优点是精馏后可以直接水解得到V2O5,原因是②利用含V2O588%的原料,采用湿法治金依次除去相关杂质,也可以得到V2O5,这种设计的缺点是
您最近一年使用:0次
名校
解题方法
6 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
I.(1)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验溶液是否被氧化的方法:_______ 。
II.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备绿矾FeSO4·7H2O的流程如下:
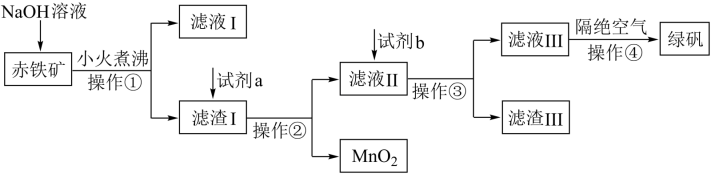
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_______ 。
(3)向滤渣I中加入过量的试剂a为_______ ,试剂b要加入过量,试剂b为_______ 。
(4)操作④隔绝空气的目的是_______ 。
Ⅲ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2是_______ (填氧化剂、还原剂),与CO2反应的化学反应方程式_______ 。
(6)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为_______ mol。
I.(1)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验溶液是否被氧化的方法:
II.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备绿矾FeSO4·7H2O的流程如下:

(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为
(3)向滤渣I中加入过量的试剂a为
(4)操作④隔绝空气的目的是
Ⅲ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2是
(6)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
2021-03-10更新
|
288次组卷
|
2卷引用:江西省赣州市赣县第三中学2020-2021学年高一下学期3月月考化学试题
11-12高一上·黑龙江绥化·期末
名校
解题方法
7 . 向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误 的是
| A.该溶液中一定含有SCN- | B.氧化性:Fe3+>Cl2 |
| C.Fe2+与SCN-不能形成红色物质 | D.Fe2+被氧化为Fe3+ |
您最近一年使用:0次
2020-08-23更新
|
983次组卷
|
25卷引用:2016-2017学年江西省南昌市第十中学高一下学期分班考试化学试卷
2016-2017学年江西省南昌市第十中学高一下学期分班考试化学试卷(已下线)2010-2011学年黑龙江省庆安县第三中学高一上学期期末考试化学试卷(已下线)2010—2011学江苏省扬州中学高二学业水平测试考前练习化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷2014-2015学年山东省菏泽市高一下学期期终考试化学试卷云南省景谷一中2018-2019学年高一下学期期末考试化学试题(已下线)2019年8月5日《每日一题》2020年高考一轮复习—— Fe2+、Fe3+的检验黑龙江省安达市第七中学2019-2020学年高一上学期月考化学试题山西省应县第一中学校2019-2020学年高一上学期第四次月考化学试题广西河池市都安县第二高级中学2019-2020学年高一上学期期末考试化学试题(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)鲁科版(2019)高一必修第一册高效手册——第3章 物质的性质与转化四川省自贡市田家炳中学2020-2021学年高一12月月考化学试题专题9 第二单元 探究铁及其化合物的转化-高中化学必修第二册苏教版2019(已下线)专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)天津市咸水沽第一中学2022-2023学年高三上学期学开学考试化学试题2019版鲁科化学必修第一册第3章第1节 铁的多样性课后习题辽宁省大石桥市第三高级中学2021-2022学年高一12月月考化学试题山东省单县第二中学2021-2022学年高一上学期11月段考化学试题山东省枣庄市滕州市2022-2023学年高一下学期开学考试化学试题广东省韶关市武江区北江实验中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题九 铁及其化合物内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题山东省滨州市惠民县第二中学2023-2024学年高一上学期12月月考化学试题云南省祥华教育集团2023-2024学年高一下学期5月联考化学试题



