解题方法
1 . 某校化学兴趣小组探究 与
与 溶液的反应,所用装置(部分夹持装置略去)如图所示。
溶液的反应,所用装置(部分夹持装置略去)如图所示。
(1)仪器a的名称为______ 。
(2)甲装置用于制 ,试管中盛放的试剂是
,试管中盛放的试剂是______ (填“浓硫酸”或“稀硫酸”)。
(3)实验室配制80mL1.5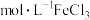 溶液,定容快接近刻度线时,应改用
溶液,定容快接近刻度线时,应改用______ (填仪器名称)。
(4)该小组同学向乙中的 溶液中通入足量的
溶液中通入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为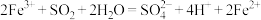 ,乙中试管最终呈
,乙中试管最终呈______ (填“浅绿色”或“浅黄色”)。
(5)反应后打开乙装置中仪器a的活塞,逐滴加入经煮沸后冷却的NaOH溶液,观察到有______ (填“灰绿色”或“白色”)沉淀生成。
 与
与 溶液的反应,所用装置(部分夹持装置略去)如图所示。
溶液的反应,所用装置(部分夹持装置略去)如图所示。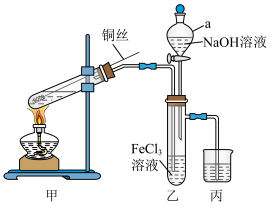
(1)仪器a的名称为
(2)甲装置用于制
 ,试管中盛放的试剂是
,试管中盛放的试剂是(3)实验室配制80mL1.5
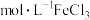 溶液,定容快接近刻度线时,应改用
溶液,定容快接近刻度线时,应改用(4)该小组同学向乙中的
 溶液中通入足量的
溶液中通入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为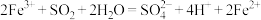 ,乙中试管最终呈
,乙中试管最终呈(5)反应后打开乙装置中仪器a的活塞,逐滴加入经煮沸后冷却的NaOH溶液,观察到有
您最近一年使用:0次
名校
解题方法
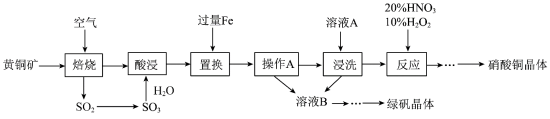
2 . 研究人员拟设计黄铜矿(主要含CuFeS2)制备硝酸铜和绿矾晶体的流程如下:
(1)CuFeS2中铁元素的化合价为___________ 价,已知“焙烧”生成SO2、CuO和Fe2O3,则其化学反应方程式为___________ 。
(2)“置换”步骤中发生的所有反应的离子方程式有___________ 、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑。
(3)流程中“操作 A”所需的玻璃仪器有_____________ 。
(4)“浸洗”步骤中加溶液A 的目的是_______________ 。
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:___________ 。
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为_______________ 。
(1)CuFeS2中铁元素的化合价为
(2)“置换”步骤中发生的所有反应的离子方程式有
(3)流程中“操作 A”所需的玻璃仪器有
(4)“浸洗”步骤中加溶液A 的目的是
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为
您最近一年使用:0次
3 . 针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
(1)最活泼的金属元素是___________ (填元素符号),最高价氧化物对应水化物酸性最强的是___________ (填氧化物对应水化物的化学式)。
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程___________ 。
(3)①②⑦的原子半径由大到小的顺序为___________ (填元素符号)。
(4)①和⑧非金属性比较①___________ ⑧(填>、<或=),请设计实验证明___________ (用一个化学方程式表示)。
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式___________ 。
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程
(3)①②⑦的原子半径由大到小的顺序为
(4)①和⑧非金属性比较①
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式
(6)为证明某溶液中不含Fe3+而可能含有Fe2+,选用下列试剂进行实验,可行的操作顺序___________。
①加入少量的氯水 ②加入少量酸性KMnO4溶液 ③加入KSCN溶液
| A.①③ | B.③② | C.③① | D.①② |
您最近一年使用:0次
名校
解题方法
4 . 粉煤灰是燃煤产生的工业固体废料,主要成分有 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
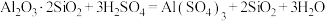

(1)“结晶”操作:缓缓加热,浓缩至___________ ,放置冷却,得到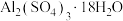 。
。
(2)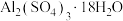 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
___________ 。
(3)“还原焙烧”过程中发生反应的化学方程式为___________ 。
(4)设计实验检验粗氧化铝中是否含有 :
:___________ 。
(5)向硅酸钠溶液中通入过量 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为___________ 。
 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下: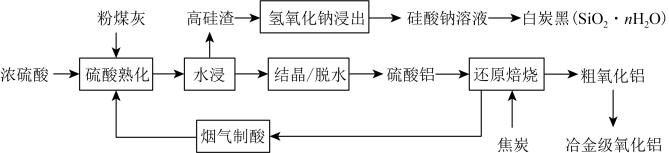
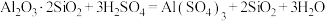

(1)“结晶”操作:缓缓加热,浓缩至
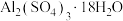 。
。(2)
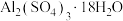 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
(3)“还原焙烧”过程中发生反应的化学方程式为
(4)设计实验检验粗氧化铝中是否含有
 :
:(5)向硅酸钠溶液中通入过量
 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为
您最近一年使用:0次
解题方法
5 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用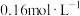
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有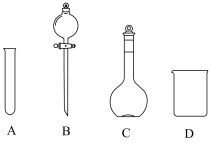
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用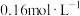
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
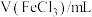 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
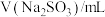 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近一年使用:0次
名校
解题方法
6 . 钢铁表面发黑(在钢铁表面形成一层致密的氧化物膜)可提高其耐磨、耐腐蚀性能。某实验小组欲利用下列装置进行发黑实验,并探究氧化物成分。
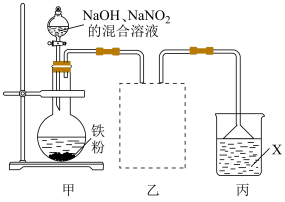
已知:实验过程中产生了一种能使湿润的红色石蕊试纸变蓝的气体。
(1)实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是___________ 和___________ 。
(2)向圆底烧瓶中逐滴滴入 、
、 的混合溶液至过量,在140℃下处理15~90min。
的混合溶液至过量,在140℃下处理15~90min。
①盛装混合溶液的仪器为___________ 。
②下列加热方法中,最合适的为___________ (填标号)。
A.水浴 B.油浴 C.酒精灯
(3)用乙装置收集产生的气体,请在装置中补全仪器。___________
(4)试剂X可以为___________ 。
(5)探究甲装置中固体产物(无铁单质剩余)成分。
取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有___________ (填离子符号)。
②不用硝酸溶解固体的原因为___________ 。
③向b试管中滴入___________ (填化学式)溶液,溶液变为血红色,说明b试管中含有___________ (填离子符号)。
(6)根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:___________ 。

已知:实验过程中产生了一种能使湿润的红色石蕊试纸变蓝的气体。
(1)实验开始前需将铁粉依次放入热的碳酸钠溶液和饱和氯化铵溶液中进行处理,其目的分别是
(2)向圆底烧瓶中逐滴滴入
 、
、 的混合溶液至过量,在140℃下处理15~90min。
的混合溶液至过量,在140℃下处理15~90min。①盛装混合溶液的仪器为
②下列加热方法中,最合适的为
A.水浴 B.油浴 C.酒精灯
(3)用乙装置收集产生的气体,请在装置中补全仪器。
(4)试剂X可以为
(5)探究甲装置中固体产物(无铁单质剩余)成分。
取少量洗涤后的固体产物于试管中,滴入足量的稀硫酸,实验中固体全部溶解,无气体生成。将生成的溶液分成两份,分装于a、b两支试管中。
①向a试管中滴入酸性高锰酸钾溶液,溶液紫红色褪去,说明a试管中含有
②不用硝酸溶解固体的原因为
③向b试管中滴入
(6)根据以上信息,推测圆底烧瓶中进行发黑实验时可能发生反应的化学方程式:
您最近一年使用:0次
2024-04-04更新
|
353次组卷
|
3卷引用:辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题
名校
解题方法
7 . 长期放置的 溶液易被氧化而变质,某兴趣小组进行了如下实验:
溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验 溶液的变质程度,请将方案补充完整。
溶液的变质程度,请将方案补充完整。
③若要用酸性高锰酸钾检验 ,方法是
,方法是___________ 。(写离子反应方程式)
(2)利用部分变质的 溶液制备
溶液制备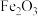 ,请在括号内填写所需试剂①
,请在括号内填写所需试剂①___________ ;②氢氧化钠溶液;③加热;
④若200mL该变质溶液制得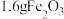 ,则变质过程中所需空气在标准状况下的体积约为
,则变质过程中所需空气在标准状况下的体积约为___________ L(结果保留两位小数)。
(3) 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案:取适量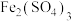 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
实验现象:紫色褪去。
由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明结论和理由:
”的结论?请说明结论和理由:___________ 。
 溶液易被氧化而变质,某兴趣小组进行了如下实验:
溶液易被氧化而变质,某兴趣小组进行了如下实验:(1)设计实验检验
 溶液的变质程度,请将方案补充完整。
溶液的变质程度,请将方案补充完整。| 实验方案 | 实验现象 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加 ① | 溶液变红 |  溶液部分变质 溶液部分变质 |
| 步骤2 | 取待检测液于试管中,向其中滴加 ② | 生成蓝色沉淀 | |
 ,方法是
,方法是(2)利用部分变质的
 溶液制备
溶液制备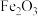 ,请在括号内填写所需试剂①
,请在括号内填写所需试剂①
④若200mL该变质溶液制得
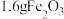 ,则变质过程中所需空气在标准状况下的体积约为
,则变质过程中所需空气在标准状况下的体积约为(3)
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:实验方案:取适量
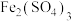 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。实验现象:紫色褪去。
由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明结论和理由:
”的结论?请说明结论和理由:
您最近一年使用:0次
8 . 某小组同学分别探究 溶液、
溶液、 溶液的性质。
溶液的性质。
Ⅰ.探究 溶液的性质。
溶液的性质。
(1)预测 具有氧化性,因此可以与Zn反应,此时Zn体现
具有氧化性,因此可以与Zn反应,此时Zn体现______ 性。
(2)预测 具有还原性,预测依据是
具有还原性,预测依据是______ ,因此可以与酸性 溶液反应。
溶液反应。
(3)进行如下实验操作:
①i中的现象是产生白色沉淀,变为灰绿色,最终为红褐色,用化学方程式表示产生该现象的原因: 、
、______ 。
②iii中的现象是______ 。
(4)某同学认为 中现象并不能证明
中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中 确实被氧化,需要在反应后的溶液中加入试剂
确实被氧化,需要在反应后的溶液中加入试剂______ ,观察到现象______ 。
Ⅱ.探究 溶液的性质。
溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(5)ⅳ中反应的离子方程式是______ 。
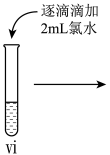
(6)vi中滴加氯水过程中,氯水反应的离子方程式是______ 。
Ⅲ.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.被转化。
(7)进一步预测 可能被转化为
可能被转化为 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象______ 。
 溶液、
溶液、 溶液的性质。
溶液的性质。Ⅰ.探究
 溶液的性质。
溶液的性质。(1)预测
 具有氧化性,因此可以与Zn反应,此时Zn体现
具有氧化性,因此可以与Zn反应,此时Zn体现(2)预测
 具有还原性,预测依据是
具有还原性,预测依据是 溶液反应。
溶液反应。(3)进行如下实验操作:
 | 序号 | 操作 |
i | 滴加 | |
iii | 加入少量锌粉 | |
iii | 滴加酸性 |
 、
、②iii中的现象是
(4)某同学认为
 中现象并不能证明
中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中 确实被氧化,需要在反应后的溶液中加入试剂
确实被氧化,需要在反应后的溶液中加入试剂Ⅱ.探究
 溶液的性质。
溶液的性质。小组同学进行如下实验操作并观察到对应现象:
操作 |
|
|
|
现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
(5)ⅳ中反应的离子方程式是
(6)vi中滴加氯水过程中,氯水反应的离子方程式是
Ⅲ.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.被转化。
(7)进一步预测
 可能被转化为
可能被转化为 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
9 . 某班同学用如下实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)甲组同学探究 与I-的反应。取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L
与I-的反应。取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L  溶液混合。分别取2mL此溶液于4支试管中进行如下实验:
溶液混合。分别取2mL此溶液于4支试管中进行如下实验:
①第一支试管中加入3滴硝酸酸化的 溶液,生成黄色沉淀;
溶液,生成黄色沉淀;
②第二支试管中加入1mL 充分振荡、静置,
充分振荡、静置, 层呈紫色;
层呈紫色;
③第三支试管中加入3滴某黄色溶液,生成蓝色沉淀;
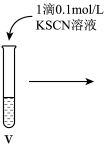
④第四支试管中加入3滴KSCN溶液,溶液变红。
实验③加入的试剂为___________ (填化学式);实验___________ (填序号)的现象可以证明该氧化还原反应为可逆反应。
(3)乙组同学设计如下实验探究亚铁盐的性质。
①实验I中由白色沉淀生成红褐色沉淀的化学方程式为___________ 。
②对实验Ⅱ所得白色沉淀展开研究:
ⅰ.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ.向ⅰ所得溶液中滴入KSCN试剂,溶液几乎不变红;
ⅲ.向ⅱ溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验中生成的白色沉淀的化学式为___________ 。溶液立即变为红色对应的离子方程式为___________ 。
(4)丙组同学向乙组同学得到的红色溶液中滴入EDTA试剂,溶液红色立即褪去。通过查阅资料,发现可能是EDTA的配合能力比 更强,加入EDTA后,EDTA与三价铁形成了更稳定的配合物,红色消失。该配合物阴离子的结构如图所示,图中M代表
更强,加入EDTA后,EDTA与三价铁形成了更稳定的配合物,红色消失。该配合物阴离子的结构如图所示,图中M代表 。配合物中C、N、O元素的第一电离能由大到小的顺序为
。配合物中C、N、O元素的第一电离能由大到小的顺序为___________ , 的配位数为
的配位数为___________ 。

 、
、 的性质。回答下列问题:
的性质。回答下列问题:(1)基态Fe原子的价层电子排布式为
(2)甲组同学探究
 与I-的反应。取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L
与I-的反应。取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L  溶液混合。分别取2mL此溶液于4支试管中进行如下实验:
溶液混合。分别取2mL此溶液于4支试管中进行如下实验:①第一支试管中加入3滴硝酸酸化的
 溶液,生成黄色沉淀;
溶液,生成黄色沉淀;②第二支试管中加入1mL
 充分振荡、静置,
充分振荡、静置, 层呈紫色;
层呈紫色;③第三支试管中加入3滴某黄色溶液,生成蓝色沉淀;
④第四支试管中加入3滴KSCN溶液,溶液变红。
实验③加入的试剂为
(3)乙组同学设计如下实验探究亚铁盐的性质。
| 实验方案 | 现象 | 查阅资料 | |
| Ⅰ | 1.0 mL 0.1 mol/L 溶液中滴加1.0 mL 0.5 mol/L NaOH溶液 溶液中滴加1.0 mL 0.5 mol/L NaOH溶液 | 生成白色沉淀,后沉淀基本变为红褐色 | 在溶液中不存在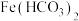 |
| Ⅱ | 1.0 mL 0.1 mol/L  溶液中滴加1.0 mL 0.5 mol/L 溶液中滴加1.0 mL 0.5 mol/L  溶液 溶液 | 生成白色沉淀,后沉淀颜色几乎不变 |
②对实验Ⅱ所得白色沉淀展开研究:
ⅰ.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ.向ⅰ所得溶液中滴入KSCN试剂,溶液几乎不变红;
ⅲ.向ⅱ溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验中生成的白色沉淀的化学式为
(4)丙组同学向乙组同学得到的红色溶液中滴入EDTA试剂,溶液红色立即褪去。通过查阅资料,发现可能是EDTA的配合能力比
 更强,加入EDTA后,EDTA与三价铁形成了更稳定的配合物,红色消失。该配合物阴离子的结构如图所示,图中M代表
更强,加入EDTA后,EDTA与三价铁形成了更稳定的配合物,红色消失。该配合物阴离子的结构如图所示,图中M代表 。配合物中C、N、O元素的第一电离能由大到小的顺序为
。配合物中C、N、O元素的第一电离能由大到小的顺序为 的配位数为
的配位数为
您最近一年使用:0次
名校
10 . 铋酸钠(NaBiO3)是常用的氧化剂,MnO2是活性电极。以辉铋矿(主要成分为Bi2S3,含FeS2、SiO2杂质)和软锰矿(主要成分是MnO2)为原料联合焙烧制备NaBiO3和MnO2,流程如下:
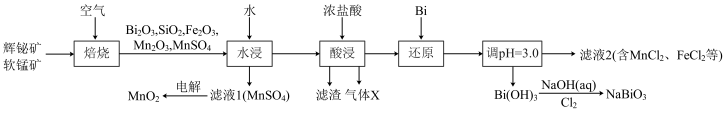
已知:①金属活动性:Fe>(H)>Bi>Cu。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1)NaBiO3中Bi的化合价为_____ 。气体X是_____ (填化学式)。
(2)“焙烧”中Bi2S3和MnO2与空气反应生成Bi2O3和MnSO4,写出其反应的化学方程式:_____ 。被还原的元素是_____ (填元素符号)。
(3)“还原”中Bi的作用是_____ 。
(4)检验滤液2中是否有FeCl3的试剂是_____ (填化学式)。
(5)已知Bi(OH)3难溶于水,NaBiO3难溶于冷水,写出冷水中利用Bi(OH)3制备NaBiO3的离子方程式:_____ 。
(6)为探究Cl2和NaBiO3的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:NaBiO3_____ Cl2(填“>”或“<”)。与根据第(5)小题得出的NaBiO3与Cl2氧化性强弱关系相反,其主要原因是_____ 。

已知:①金属活动性:Fe>(H)>Bi>Cu。
②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 6.3 | 8.3 |
| Mn2+ | 8.1 | 10.1 |
(1)NaBiO3中Bi的化合价为
(2)“焙烧”中Bi2S3和MnO2与空气反应生成Bi2O3和MnSO4,写出其反应的化学方程式:
(3)“还原”中Bi的作用是
(4)检验滤液2中是否有FeCl3的试剂是
(5)已知Bi(OH)3难溶于水,NaBiO3难溶于冷水,写出冷水中利用Bi(OH)3制备NaBiO3的离子方程式:
(6)为探究Cl2和NaBiO3的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:NaBiO3
您最近一年使用:0次