1 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 实验结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol/L的CH3COONH4和NaHCO3溶液的pH,后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入高锰酸钾溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 | 生成黑色沉淀 | Ksp(ZnS)>Ksp(CuS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 工业上,处理低品位黄铜矿[二硫化亚铁铜( )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
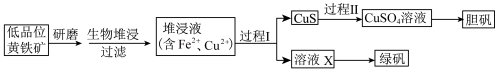
资料:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)生物堆浸过程中,应控制溶液的pH在___________ 范围内。
(4) 在过程Ⅰ中被还原为
在过程Ⅰ中被还原为 。
。
①若过程Ⅰ中只加入一种试剂,在下列常见还原剂中可选择___________ 。
a. b.
b. c.
c. d.Cu
d.Cu
② 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程Ⅰ中若加入
。过程Ⅰ中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有___________ 、___________ (忽略该过程中所有涉及配合物的反应)。
③为判断堆浸液中 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入___________ (填试剂的化学式),观察溶液颜色变化。
(5)向过程Ⅰ所得固体中加入___________ (填试剂的化学式),过滤,可得CuS固体。然后加 和稀硫酸,CuS
和稀硫酸,CuS完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
 )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
资料:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
 |  |  | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(1)生物堆浸前,需先将矿石进行研磨,目的是
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)生物堆浸过程中,应控制溶液的pH在
(4)
 在过程Ⅰ中被还原为
在过程Ⅰ中被还原为 。
。①若过程Ⅰ中只加入一种试剂,在下列常见还原剂中可选择
a.
 b.
b. c.
c. d.Cu
d.Cu②
 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程Ⅰ中若加入
。过程Ⅰ中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有③为判断堆浸液中
 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入(5)向过程Ⅰ所得固体中加入
 和稀硫酸,CuS
和稀硫酸,CuS 的作用是
的作用是
您最近一年使用:0次
3 . 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是
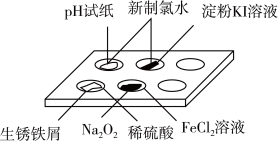

A.新制氯水滴加到 试纸以及淀粉 试纸以及淀粉 溶液孔穴中,都体现新制氯水的漂白性 溶液孔穴中,都体现新制氯水的漂白性 |
B.生锈铁屑加入过量稀硫酸反应后,若加入 后溶液褪色,说明该溶液中有 后溶液褪色,说明该溶液中有 存在 存在 |
C. 固体中滴加 固体中滴加 溶液后最终为白色沉淀 溶液后最终为白色沉淀 |
| D.生锈铁屑加入足量稀硫酸后,若加入KSCN溶液,溶液一定变血红色 |
您最近一年使用:0次
2023-10-03更新
|
639次组卷
|
11卷引用:内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题
内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题浙江省北斗联盟2021-2022学年高一下学期期中联考化学试题(已下线)第07练 铁及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(1-10)河北省部分重点高中2023-2024学年高三上学期第一次综合素养测评化学试题广东省河源中学2023-2024学年上学期高三年级一调考试化学试题河北省衡水中学2023-2024学年高三上学期一调考试化学试题河北省石家庄市部分名校2024届高三上学期一调考试化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题辽宁省沈阳市第二中学2023-2024学年高三上学期期末模拟考试化学试题河北省唐山市第二十三中2023-2024学年高三上学期期中考试化学试题
解题方法
4 . 铁、铝、铜是制造潜艇必不可少的重要金属材料。下列说法正确的是
| A.三种金属形成的氧化物均为碱性氧化物 |
| B.Cu不能与AlCl3溶液、FeCl3溶液发生反应 |
| C.任何情况下,三种金属都不能与水反应 |
| D.用惰性电极电解含有Fe3+、Al3+、Cu2+的混合溶液时Fe3+优先放电 |
您最近一年使用:0次
名校
解题方法
5 . 将一定量的Fe、Cu、CuCl2、FeCl3放入同一烧杯中,加入适量蒸馏水,充分反应后,仍有固体存在,则下列判断不正确的是
| A.充分反应后的溶液中不一定含Cu2+ |
| B.充分反应后的溶液中一定含有Fe2+,可能含有Fe3+ |
| C.剩余固体中一定含Cu,可能含Fe |
| D.向充分反应后溶液中加入KSCN溶液一定不变红色 |
您最近一年使用:0次
2023-01-06更新
|
284次组卷
|
2卷引用:内蒙古集宁一中2022-2023学年高一上学期期末考试化学试题
名校
6 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃—5℃、碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
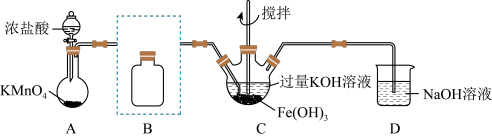
①装浓盐酸的仪器名称___________ 。
②将除杂装置B补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中Cl2发生的化学反应有: ,另外还有
,另外还有______ (写离子方程式):在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了 而产生Cl2,设计以下方案:
而产生Cl2,设计以下方案:
i.由方案I中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4将 氧化,还可能的原因
氧化,还可能的原因___________ 。
ii.方案II可证明K2FeO4氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________  (填“>”或“<”),而方案II实验表明,Cl2和
(填“>”或“<”),而方案II实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃—5℃、碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①装浓盐酸的仪器名称
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中Cl2发生的化学反应有:
 ,另外还有
,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了
 而产生Cl2,设计以下方案:
而产生Cl2,设计以下方案:| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
 氧化,还可能的原因
氧化,还可能的原因ii.方案II可证明K2FeO4氧化了
 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和
(填“>”或“<”),而方案II实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2021-10-27更新
|
598次组卷
|
2卷引用:内蒙古通辽和市赤峰市部分学校联考2021-2022学年高三上学期10月联考质量检测化学试题
7 . 已知A为单质,与某物质反应生成气体与B,有以下物质相互转化:
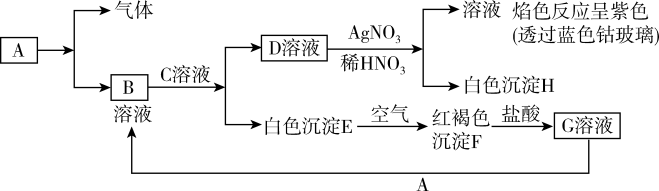
(1)写出B的化学式____ ,D的化学式________ 。
(2)写出由E转变成F的化学方程式______ 。
(3)写出用KSCN鉴别G溶液的离子方程式__ ,向G溶液加入A的有关离子反应方程式__ 。

(1)写出B的化学式
(2)写出由E转变成F的化学方程式
(3)写出用KSCN鉴别G溶液的离子方程式
您最近一年使用:0次
名校
解题方法
8 . 草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
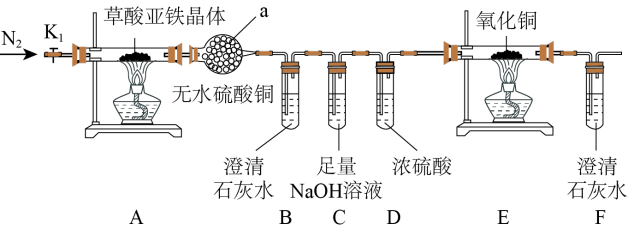
(1)仪器a的名称是______ 。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________ 。
(3)实验前先通入一段时间N2,其目的为__________ 。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____ 。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
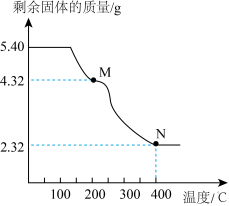
①上图中M点对应物质的化学式为_________ 。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______ 。

(1)仪器a的名称是
(2)从绿色化学考虑,该套装置存在的明显缺陷是
(3)实验前先通入一段时间N2,其目的为
(4)实验证明了气体产物中含有CO,依据的实验现象为
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:
您最近一年使用:0次
2020-03-15更新
|
1056次组卷
|
7卷引用:内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
9 . 已知:Cu2O+H2SO4 = Cu+CuSO4 +H2O 。某红色粉末样品可能含有 Fe2O3 和 Cu2O 中的一种或两种,为探究其组成,取少量样品加入过量稀硫酸。下列有关说法正确的是
| A.若固体全部溶解,则发生的离子反应只有:Fe2O3+6H+=2Fe3+ +3H2O |
| B.若固体部分溶解,则样品中一定含有 Cu2O,一定不含有 Fe2O3 |
| C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,则样品中 n(Fe2O3):n(Cu2O)为 2:1 |
| D.另取 ag 样品在空气中充分加热至质量不再变化,称其质量为 b g(b>a),则混合物中 Cu2O 的质量分数为 9(b-a)/a |
您最近一年使用:0次
2020-02-17更新
|
1830次组卷
|
14卷引用:内蒙古包钢第一中学2022-2023学年高三上学期11月月考化学试题
内蒙古包钢第一中学2022-2023学年高三上学期11月月考化学试题浙江省温州市2019-2020学年高一上学期期末教学质量统一检测化学试题(已下线)【新东方】2020-91辽宁省实验中学东戴河校区2021届高三上学期第一次月考化学试题辽宁省沈阳辽宁省实验中学2021届高三上学期月考化学试题湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00146】(已下线)专题讲座(一) 阿伏加德罗常数的突破(练) — 2022年高考化学一轮复习讲练测(新教材新高考)安徽省合肥市(五中、七中、十中)2021-2022学年高三上学期联考化学试题浙江省吴兴高级中学2021-2022学年高一下学期返校学情检测化学试题甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题湖南省湘潭市2022-2023学年高一上学期1月期末考试化学试题河南省新乡市2022-2023学年高一上学期选科调研第二次测试化学试题河南省新乡市第一中学2022-2023学年高一上学期12月期中考试化学试题
解题方法
10 . 下列实验现象、解释与结论均正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了变性 |
| B | 某卤代烃与氢氧化钠的乙醇溶液混合共热。气体导入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 说明生成了不饱和烃 |
| C | FeCl3溶液与KSCN溶液混合 | 红色溶液 | 用于检验Fe2+ |
| D | 向蔗糖中加入浓硫酸 | 蔗糖变黑,体积膨胀,放热并放出刺激性气味气体 | 浓硫酸有脱水性和强氧化性,反应生成C、SO2和CO2等 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



