名校
解题方法
1 .  由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的
由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的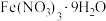 晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化: 为浅紫色,
为浅紫色,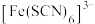 为红色,
为红色, 为无色。
为无色。
下列说法错误的是
 由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的
由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的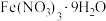 晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化: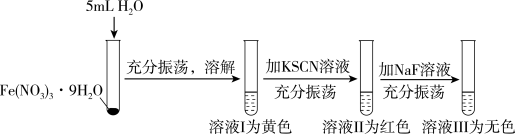
 为浅紫色,
为浅紫色,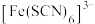 为红色,
为红色, 为无色。
为无色。下列说法错误的是
A.溶液Ⅰ呈黄色,可能是因为 水解生成Fe(OH)3所致 水解生成Fe(OH)3所致 |
B. 与 与 形成配位键时,S原子提供孤电子对 形成配位键时,S原子提供孤电子对 |
C.溶液Ⅱ、Ⅲ现象说明与 配位 配位 强于 强于 |
| D.由于铁灼烧时无焰色且不会产生发射光谱,故焰色试验中可用铁丝替代铂丝 |
您最近一年使用:0次
2023-07-15更新
|
660次组卷
|
4卷引用:山东省青岛市莱西市2022-2023学年高三上学期期末考试化学试题
山东省青岛市莱西市2022-2023学年高三上学期期末考试化学试题江西省萍乡市安源中学2022-2023学年高二下学期期中考试化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题(已下线)化学(天津卷03)-2024年高考化学押题预测卷
解题方法
2 . 硫代硫酸钠 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。
资料:i.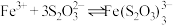 (紫黑色)
(紫黑色) 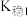 ;
;
ii. 为白色沉淀,
为白色沉淀,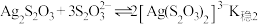 ;
;
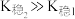 。
。
回答下列问题:
探究一
(1)根据实验①的现象,初步判断最终 被
被 还原为
还原为 ,通过
,通过_____ (填操作、试剂和现象),进一步证实生成了 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为_____ 。
(2)氧化性: (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是_____ 。
探究二
(3)实验③中黑色沉淀可能为 或
或 。通过
。通过_____ (填操作、试剂和现象),进一步证实生成了 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为_____ 。
(4)将 溶液逐滴滴入
溶液逐滴滴入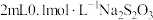 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为_____ 。
 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。资料:i.
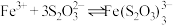 (紫黑色)
(紫黑色) 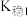 ;
;ii.
 为白色沉淀,
为白色沉淀,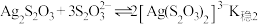 ;
;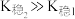 。
。回答下列问题:
探究一
| 装置 | 编号 | 试剂X | 实验现象 |
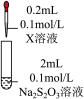 | ① | 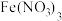 溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 一段时间后,生成白色沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 ,通过
,通过 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为(2)氧化性:
 (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是探究二
| 装置 | 编号 | 试剂X | 实验现象 |
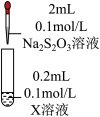 | ③ |  溶液 溶液 | 立即生成白色絮状沉淀,沉淀很快变为黑色沉淀。 |
 或
或 。通过
。通过 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为(4)将
 溶液逐滴滴入
溶液逐滴滴入 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为
您最近一年使用:0次
3 . X、Y、Z、W为原子序数依次增大的短周期主族元素。X的电子总数等于电子层数,Y最外层电子数为电子层数的3倍,Z的气态氢化物与其最高价氧化物的水化物反应可生成Z的单质。由上述四种元素及元素Q组成的物质之间的转化关系如图所示,其中C为强酸,D、N分别是元素Q和W组成的单质(反应过程中部分产物略去)。
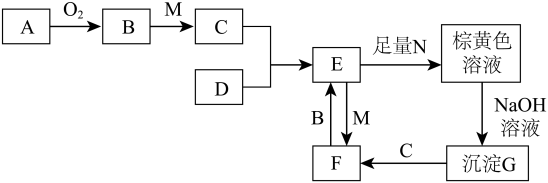
回答下列问题:
(1)W在元素周期表中的位置是___________ ;Z简单阴离子的结构示意图为___________ 。
(2)若A与M均为 微粒,则A的化学式为
微粒,则A的化学式为___________ ,M的电子式为___________ ;
(3)Y、Z、W的非金属性由强到弱的顺序为___________ (用元素符号表示)。
(4)F与B反应生成E的离子方程式为___________ 。
(5)500℃,向恒容密闭容器中通入等物质的量的B(g)与O2(g)充分反应。下列叙述不能判断该反应达到平衡状态的是___________ (填序号)。
①气体压强保持不变
②气体密度保持不变
③混合气体的平均摩尔质量不再变化
④ 为定值
为定值
⑤B的质量不再改变
⑥容器内原子总数不再变化

回答下列问题:
(1)W在元素周期表中的位置是
(2)若A与M均为
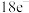 微粒,则A的化学式为
微粒,则A的化学式为(3)Y、Z、W的非金属性由强到弱的顺序为
(4)F与B反应生成E的离子方程式为
(5)500℃,向恒容密闭容器中通入等物质的量的B(g)与O2(g)充分反应。下列叙述不能判断该反应达到平衡状态的是
①气体压强保持不变
②气体密度保持不变
③混合气体的平均摩尔质量不再变化
④
 为定值
为定值⑤B的质量不再改变
⑥容器内原子总数不再变化
您最近一年使用:0次
解题方法
4 .  可用于制备补铁剂,也可制备铁红
可用于制备补铁剂,也可制备铁红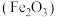 。以下是用磁铁矿(主要成分
。以下是用磁铁矿(主要成分 、含
、含 和
和 等杂质)制取
等杂质)制取 的工艺流程:
的工艺流程:
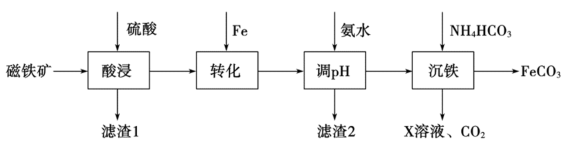
已知:① 不溶于水,也不与硫酸反应;②调
不溶于水,也不与硫酸反应;②调 可将
可将 转化为沉淀与
转化为沉淀与 分离,但不能将
分离,但不能将 与
与 分离。
分离。
请回答下列问题:
(1)“酸浸”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“转化”工序加入Fe的作用是___________ 。
(3)滤渣1的成分是___________ (填化学式)。
(4)“沉铁”发生反应的离子方程式为___________ 。
(5)产品 在空气中煅烧可制备铁红,写出反应的化学反应方程式
在空气中煅烧可制备铁红,写出反应的化学反应方程式___________ ;在实验室中完成本操作所用的主要仪器是___________ (填序号)。
A. B.
B. C.
C.
若起始时 的质量为
的质量为 ,最终制得
,最终制得 为
为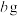 ,则
,则 产率为
产率为___________ 。(产率= ,用含
,用含 ,
, 的代数式表示)。
的代数式表示)。
 可用于制备补铁剂,也可制备铁红
可用于制备补铁剂,也可制备铁红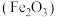 。以下是用磁铁矿(主要成分
。以下是用磁铁矿(主要成分 、含
、含 和
和 等杂质)制取
等杂质)制取 的工艺流程:
的工艺流程:
已知:①
 不溶于水,也不与硫酸反应;②调
不溶于水,也不与硫酸反应;②调 可将
可将 转化为沉淀与
转化为沉淀与 分离,但不能将
分离,但不能将 与
与 分离。
分离。请回答下列问题:
(1)“酸浸”时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“转化”工序加入Fe的作用是
(3)滤渣1的成分是
(4)“沉铁”发生反应的离子方程式为
(5)产品
 在空气中煅烧可制备铁红,写出反应的化学反应方程式
在空气中煅烧可制备铁红,写出反应的化学反应方程式A.
 B.
B. C.
C.
若起始时
 的质量为
的质量为 ,最终制得
,最终制得 为
为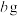 ,则
,则 产率为
产率为 ,用含
,用含 ,
, 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-02-12更新
|
424次组卷
|
2卷引用:山东省德州市2022-2023学年高一上学期期末考试化学试题
名校
5 . 电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。为改善环境,废物利用,可从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜并使腐蚀液再生。处理流程如下图:

(1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(2)废液中加入过量金属A时发生置换反应的离子反应方程式为:_______ 。
(3)检验废液中是否含有Fe3+所需要试剂名称为_______ ;
试剂F宜选用下列试剂中的_______ (填选项序号),
A.酸性KMnO4溶液 B.氯水 C.溴水 D.稀硝酸
若将上面所选试剂F换成H2O2,也能达到同样目的。请写出试剂F为H2O2时反应的离子方程式:_______ 。
(4)若要检验Fe2(SO4)3溶液中是否含有FeSO4,可选用的最佳试剂为______(填选项序号)
(5)若向滤液B中加入氢氧化钠溶液并在空气中放置一段时间,沉淀转化的化学方程式为:_______ 。

(1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(2)废液中加入过量金属A时发生置换反应的离子反应方程式为:
(3)检验废液中是否含有Fe3+所需要试剂名称为
试剂F宜选用下列试剂中的
A.酸性KMnO4溶液 B.氯水 C.溴水 D.稀硝酸
若将上面所选试剂F换成H2O2,也能达到同样目的。请写出试剂F为H2O2时反应的离子方程式:
(4)若要检验Fe2(SO4)3溶液中是否含有FeSO4,可选用的最佳试剂为______(填选项序号)
| A.氢氧化钠溶液 | B.氯水 | C.酸性KMnO4溶液 | D.稀硝酸 |
您最近一年使用:0次
2023-01-14更新
|
433次组卷
|
3卷引用:山东师范大学附属中学 2022-2023 学年高一上学期学科水平自我诊断化学试题
6 . 黑色化合物M由两种常见的元素组成,各物质的转化关系如图所示。

回答下列问题:
(1)D是_______ (填化学式)。
(2)将A通入新制氯水中发生主要反应的离子方程式为_______ 。
(3)为了探究温度对D和氨气反应的产物的影响,设计实验:
①根据上述现象,得出实验结论:E为 (X表示形成化合物M的一种元素),F为
(X表示形成化合物M的一种元素),F为_______ (填化学式)。
②乙组实验中,步骤Ⅲ中溶液由无色变红的原因是_______ (用离子方程式表示)。
③通过交流、讨论,有人认为E中除 外还可能含
外还可能含_______ (填化学式),判断的理由是_______ 。

回答下列问题:
(1)D是
(2)将A通入新制氯水中发生主要反应的离子方程式为
(3)为了探究温度对D和氨气反应的产物的影响,设计实验:
| 步骤 | 操作 | E(甲组) | F(乙组) |
| Ⅰ | 取少量产物,加入稀盐酸 | 溶解、无气泡 | 溶解,有气泡 |
| Ⅱ | 取步骤Ⅰ中溶液,滴加KSCN溶液 | 溶液变红 | 无明显变化 |
| Ⅲ | 向步骤Ⅱ溶液中滴加双氧水 | 红色变深 | 溶液变红 |
 (X表示形成化合物M的一种元素),F为
(X表示形成化合物M的一种元素),F为②乙组实验中,步骤Ⅲ中溶液由无色变红的原因是
③通过交流、讨论,有人认为E中除
 外还可能含
外还可能含
您最近一年使用:0次
7 . 某化学兴趣小组对硫酸亚铁的性质进行探究并做如下实验,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸中配制成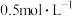 的溶液:
的溶液:
回答下列问题:
(1)进一步研究证实,黑色沉淀的主要成分是 。
。 溶液呈碱性,
溶液呈碱性, 溶液与其反应不生成
溶液与其反应不生成 而生成
而生成 的可能原因是
的可能原因是_______ 。
(2用离子方程式表示步骤ⅱ中溶液变红的原因:_______ 、_______ 。
(3)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. 被
被 还原 b.
还原 b. 被
被 氧化 c.
氧化 c. 被
被 氧化
氧化
乙同学根据上述实验认为假设b不成立,他依据的现象是_____ 。
(4)甲同学利用上述部分试剂,通过以下实验验证了(3)中假设c成立。请将以下实验操作及现象补充完整。
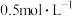 的溶液:
的溶液:| 实验序号 | 操作及现象 |
| ⅰ | 取 上述 上述 溶液于试管中,逐滴加入少量 溶液于试管中,逐滴加入少量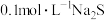 溶液,产生大量黑色沉淀 溶液,产生大量黑色沉淀 |
| ⅱ | 取 上述 上述 溶液于试管中,加入2滴 溶液于试管中,加入2滴 溶液无现象,通入一段时间 溶液无现象,通入一段时间 ,溶液变为浅红色 ,溶液变为浅红色 |
| ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% 溶液至过量,产生无色气体(经检验为 溶液至过量,产生无色气体(经检验为 ),溶液变为深红色中,且红色很快褪去 ),溶液变为深红色中,且红色很快褪去 |
(1)进一步研究证实,黑色沉淀的主要成分是
 。
。 溶液呈碱性,
溶液呈碱性, 溶液与其反应不生成
溶液与其反应不生成 而生成
而生成 的可能原因是
的可能原因是(2用离子方程式表示步骤ⅱ中溶液变红的原因:
(3)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.
 被
被 还原 b.
还原 b. 被
被 氧化 c.
氧化 c. 被
被 氧化
氧化乙同学根据上述实验认为假设b不成立,他依据的现象是
(4)甲同学利用上述部分试剂,通过以下实验验证了(3)中假设c成立。请将以下实验操作及现象补充完整。
| 步骤 | 试剂及操作 | 现象 |
| 1 | 取实验ⅲ中褪色后溶液少量于试管,滴加 溶液 溶液 | ① |
| 2 | ② | 溶液变为红色 |
您最近一年使用:0次
2021-06-25更新
|
266次组卷
|
2卷引用:山东省莱州市2020-2021学年高二下学期期末考试化学试题
8 .  溶液常用于鉴别
溶液常用于鉴别 。在水溶液中,
。在水溶液中, 以
以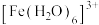 形式存在,与
形式存在,与 可发生反应:
可发生反应: 能溶于乙醚。下列说法错误的是
能溶于乙醚。下列说法错误的是
 溶液常用于鉴别
溶液常用于鉴别 。在水溶液中,
。在水溶液中, 以
以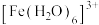 形式存在,与
形式存在,与 可发生反应:
可发生反应: 能溶于乙醚。下列说法错误的是
能溶于乙醚。下列说法错误的是A. 显红色 显红色 |
| B.该鉴别方法不受溶液酸碱性的限制 |
C.当 浓度很低时,用乙醚富集可使现象明显 浓度很低时,用乙醚富集可使现象明显 |
| D.加水稀释,平衡左移,溶液颜色变浅 |
您最近一年使用:0次
2021-02-08更新
|
397次组卷
|
3卷引用:山东省威海市2021届高三上学期期末考试化学试题
9 . 由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO4・7H2O)的流程如下:
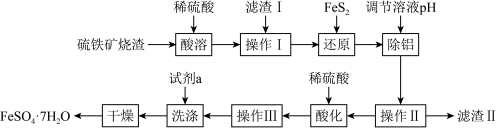
已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________ ;滤渣Ⅱ经灼烧后可用于_______ (写出一种用途即可)。
(2)“还原”的目的是__________ ,写出“还原”步骤中涉及反应的离子方程式_________ 。
(3)“除铝”反应过程中控制的pH范围是_______________________ 。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________ ,“洗涤”时的试剂最好选用下列中的____________ (填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________ 。

已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(2)“还原”的目的是
(3)“除铝”反应过程中控制的pH范围是
(4)操作Ⅲ包含3个基本的实验操作,依次是
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:
您最近一年使用:0次
名校
10 . 王老师做了一个如图所示的实验,发现烧杯中酸性 KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色,判断下列说法中正确的是
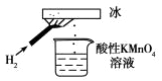

| A.该条件下生成的水分子化学性质比较活泼 |
| B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性 |
| C.该条件下H2燃烧生成了只具有氧化性的物质 |
| D.该条件下H2燃烧的产物中可能含有一定量的 H2O2 |
您最近一年使用:0次
2018-11-15更新
|
329次组卷
|
4卷引用:山东省泰安市2020-2021学年高一上学期期末考试化学试题



