2020高三·北京·专题练习
名校
解题方法
1 . 某小组同学探究 SO2 与 Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3- Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)
结合上述实验,下列说法不正确的是
 Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)| 实验 | ① | ② | ③ |
| 操作 | 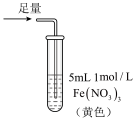 | 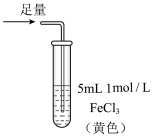 | 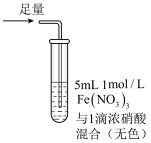 |
| 现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
| A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率 |
| B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响 |
| C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性 |
| D.5h后③比①黄色更深不能证明是 NO3-浓度的增大减慢了SO2与Fe3+反应的速率 |
您最近一年使用:0次
名校
解题方法
2 .  溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓
溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓 得溶液 b,溶液b较溶液 a黄色加深。已知:
得溶液 b,溶液b较溶液 a黄色加深。已知: (黄色);浓度较小时
(黄色);浓度较小时  (用
(用 表示)几乎无色。取溶液进行如下实验,对现象分析错误的是
表示)几乎无色。取溶液进行如下实验,对现象分析错误的是
 溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓
溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓 得溶液 b,溶液b较溶液 a黄色加深。已知:
得溶液 b,溶液b较溶液 a黄色加深。已知: (黄色);浓度较小时
(黄色);浓度较小时  (用
(用 表示)几乎无色。取溶液进行如下实验,对现象分析错误的是
表示)几乎无色。取溶液进行如下实验,对现象分析错误的是A.测溶液 a的  约为1.3,证明 约为1.3,证明  发生了水解 发生了水解 |
B.向 b中加入  后,会产生白色沉淀 后,会产生白色沉淀 |
C.向 b中滴入  溶液变血红色,说明 溶液变血红色,说明  的配位键稳定性大于 的配位键稳定性大于  |
D.将溶液 a稀释,颜色变浅,主要是因为  浓度降低导致 浓度降低导致 |
您最近一年使用:0次
2024-01-31更新
|
208次组卷
|
4卷引用:黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学验收考试化学
名校
3 . 实验小组用如图装置探究Cl2、Fe3+、I2的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
已知:I2遇淀粉溶液变蓝

实验过程:
I.打开弹簧夹K1和K2,通入一段时间N2,再将导管插入B中,继续通入N2一段时间,然后夹紧K1;
Ⅱ.打开活塞a,滴加一定量浓盐酸后关闭活塞a,给A加热;
Ⅲ.当B中的溶液变为黄色时,停止加热,夹紧K2;
IV.打开活塞b,将少量B中溶液滴入C中,关闭活塞b。
(1)操作I中通入一段时间N2的目的是
(2)浸有NaOH溶液的棉花的作用是
(3)B中溶液变黄说明氧化性Cl2>Fe3+,反应的离子方程式是
(4)为探究Fe3+和I2的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测B中黄色溶液和C中混合溶液中的部分微粒,结果如表所示(忽略空气中O2的影响)。
B中部分微粒 | C中部分微粒 | |
甲 | 既有Fe3+又有Fe2+ | 有I2 |
乙 | 有Fe3+无Fe2+ | 有I2 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
①检验B中黄色溶液中含有Fe3+的试剂是
②进一步检验IL的实验操作及现象是
③能证明该实验条件下氧化性Fe3+>I2的有
不能证明的请说明理由
④已知碘原子的原子结构示意图为 ,从原子结构角度解释碘原子的得电子能力弱于氯原子的原因
,从原子结构角度解释碘原子的得电子能力弱于氯原子的原因
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向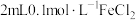 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加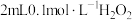 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是_____ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。
还原。
取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。
Ⅱ.乙同学认为是 被氧化。
被氧化。
取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为_____ 。
为了探究溶液褪色的原因究竞是上述的哪一种,该兴趣小组进行了如下实验。
向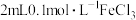 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液_____ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。
和两种可直接排放到空气中的气体。
设计实验方案验证褪色后的溶液中存在 :
:_____ 。
(4)写出上述实验中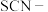 被氧化的离子方程式:
被氧化的离子方程式:_____ 。
(5)根据题目所给信息及实验现象推断物质还原性强弱:
_____ 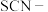 (填“>”或“<”),理由:
(填“>”或“<”),理由:_____ 。
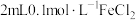 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加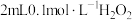 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。
还原。取褪色后溶液,滴加
 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。Ⅱ.乙同学认为是
 被氧化。
被氧化。取褪色后溶液,滴加
 溶液,出现红色。
溶液,出现红色。根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竞是上述的哪一种,该兴趣小组进行了如下实验。
向
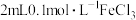 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。
和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在
 :
:(4)写出上述实验中
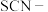 被氧化的离子方程式:
被氧化的离子方程式:(5)根据题目所给信息及实验现象推断物质还原性强弱:

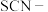 (填“>”或“<”),理由:
(填“>”或“<”),理由:
您最近一年使用:0次
名校
解题方法
5 . 下列实验探究方案不能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 将二氧化硫气体通入碘和淀粉的混合溶液中,观察溶液颜色的变化 | 探究还原性: |
| B | 向盛有 溶液的试管中滴加几滴 溶液的试管中滴加几滴 溶液。振荡,观察颜色的变化 溶液。振荡,观察颜色的变化 | 探究 是否变质 是否变质 |
| C | 加热溴乙烷和氢氧化钠-乙醇混合溶液,将产生的气体通入高锰酸钾溶液中。观察溶液颜色的变化 | 探究溴乙烷在此条件下发生的是取代反应还是消去反应 |
| D | 向盛有等浓度的NaCl和KI混合溶液的试管中滴加几滴 溶液,振荡,观察沉淀颜色 溶液,振荡,观察沉淀颜色 | 证明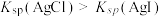 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-06更新
|
419次组卷
|
3卷引用:湖南省岳阳县一中2023-2024学年高三开学考试化学试题
6 . 下列实验现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向久置于空气中的Na2SO3溶液中加入BaCl2溶液 | 有白色沉淀生成 | Na2SO3溶液变质了 |
| B | 向某溶液中滴加KSCN溶液 | 溶液显红色 | 原溶液中有Fe3+ |
| C | 将稀盐酸滴入碳酸钠溶液中产生的气体直接通入硅酸钠溶液 | 有白色沉淀生成 | 证明非金属性Cl>C>Si |
| D | 向硝酸钡溶液中通入二氧化硫 | 有白色沉淀 | 该沉淀是亚硫酸钡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-14更新
|
469次组卷
|
3卷引用:江西省抚州市黎川县第二中学2023-2024学年高二上学期开学考试化学试题
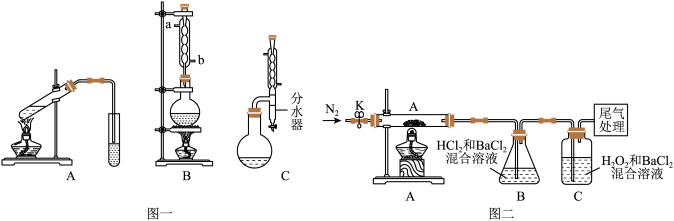
7 . 某小组同学探究 与
与 溶液的反应。
溶液的反应。
(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备 ,将
,将 通入
通入 溶液中。
溶液中。 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。
①浓 与Cu反应的化学方程式是
与Cu反应的化学方程式是_______ 。
②试剂a是_______ 。
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是_______ 。(写离子方程式)。
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与 、
、 有关。
有关。
假设2:主要与 、
、 有关。
有关。
实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向 溶液中加入
溶液中加入 溶液,
溶液,_______ (填现象),然后滴加_______ (填试剂),溶液变为黄色。
(3)进一步探究 与
与 、
、 显红棕色的原因。
显红棕色的原因。
查阅资料: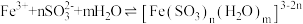 (红棕色)
(红棕色)
实验Ⅲ:向 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
甲同学认为橙黄色沉淀中可能含有 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是_______ 。
②实验证实橙黄色沉淀中含有 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是_______ 、_______ 。
(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是_______ 。
 与
与 溶液的反应。
溶液的反应。(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备
 ,将
,将 通入
通入 溶液中。
溶液中。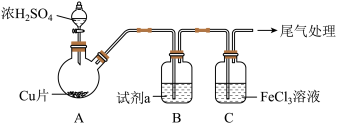
 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。①浓
 与Cu反应的化学方程式是
与Cu反应的化学方程式是②试剂a是
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与
 、
、 有关。
有关。假设2:主要与
 、
、 有关。
有关。实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向
 溶液中加入
溶液中加入 溶液,
溶液,(3)进一步探究
 与
与 、
、 显红棕色的原因。
显红棕色的原因。查阅资料:
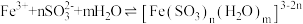 (红棕色)
(红棕色)实验Ⅲ:向
 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。甲同学认为橙黄色沉淀中可能含有
 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。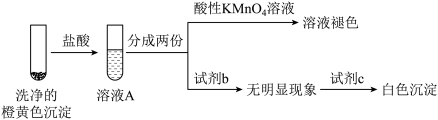
 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是②实验证实橙黄色沉淀中含有
 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是
您最近一年使用:0次
2022-11-04更新
|
689次组卷
|
6卷引用:北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题
8 . 化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______ 口进入;乙同学认为图一中C装置效果更好,理由是_______ 。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________ 不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________ 溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______ (填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________ 。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________ 。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______ 。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______ 。(填序号)

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是
您最近一年使用:0次
2019-09-29更新
|
186次组卷
|
7卷引用:云南省盈江县一中2020届高三上学期开学考试化学试题
9 . 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
(1)仪器组装完成后,夹好止水夹,__________________________________ ,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________ (填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是______ 。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________ ,写出产生上述气体的化学方程式:____________________ 。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________ mol。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
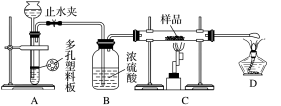
(1)仪器组装完成后,夹好止水夹,
(2)下列实验步骤中,正确的操作顺序是
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=
您最近一年使用:0次
2018-08-28更新
|
443次组卷
|
6卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期开学阶段性考试(8月)化学试题
10 . 某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________ mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________ 。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________ ,反应的离子方程式是____________________________________ 。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________ ,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________ 。
| 实验过程 | 实验现象 | |
| 实验1 |  | 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
| 方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
| 方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
b.加入稀硝酸的目的是
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是
您最近一年使用:0次
2019-01-24更新
|
396次组卷
|
2卷引用:【全国百强校】四川省成都外国语学校2018-2019学年高一下学期入学考试化学试题



