名校
解题方法
1 . 某合金(仅含铜、铁)中铜和铁的物质的量之比和为ymol,其中Cu的物质的量分数为a,将其全部投入100MLbmol•L﹣1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
| A.若金属全部溶解,则溶液中一定含有Fe3+ |
| B.若金属部分溶解,再滴入硫酸,则Fe溶解而Cu始终不溶解 |
| C.若金属全部溶解,且产生224ML气体(标准状况下),则b≥0.1 |
D.若金属全部溶解,且只得到Fe3+、Cu2+时,则b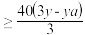 |
您最近一年使用:0次
名校
2 . 某科研课题小组研究利用含H+、Zn2+、Mn2+、Fe2+、Fe3+、Cl-、 的工业废液,制备高纯的ZnO、MnO2、Fe2O3,设计出如下实验流程:
的工业废液,制备高纯的ZnO、MnO2、Fe2O3,设计出如下实验流程:
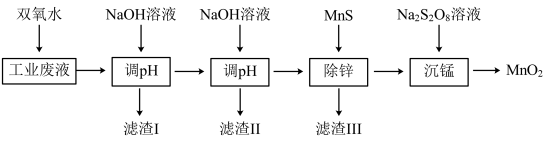
已知:①氢氧化锌沉淀呈白色
②氢氧化锰难溶于水
③溶液中金属离子沉淀完全时其浓度≤ 1×10-5mol/L
回答下列问题:
(1)向工业废液中加入双氧水,可能观察到的现象有:溶液的颜色发生变化和___________ ,其中引起溶液颜色变化的离子方程式为___________ 。
(2)第一次调pH的目的是沉淀Fe3+。检验Fe3+是否完全沉淀的操作:取少量滤液于洁净试管中,最好加入下列试剂中的___________ (填标号),并观察实验现象。
a.稀氨水 b.KSCN溶液 c.K3Fe(CN)6溶液 d.溴水
(3)第二次调pH前,科研小组成员在室温下分析此时的溶液,得到相关数据见下表
为防止Mn2+也同时沉淀造成产品不纯,最终选择将溶液的pH控制为7.5,则此时溶液中Zn2+的沉淀率为___________ 。(第二次调pH前后液体体积的变化忽略不计)
(4)已知常温下,Ksp(MnS)=3×10-14,Ksp(ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn2+(aq) ZnS(s)+Mn2+(aq),其平衡常数K
ZnS(s)+Mn2+(aq),其平衡常数K ___________ 。
(5)沉锰反应在酸性条件下完成,写出反应的离子方程式___________ 。
(6)下列关于沉锰制备高纯MnO2的说法中,不正确的是___________ (填标号)。
a.若沉锰反应时加入足量浓盐酸并加热,MnO2的产率将降低
b.若沉锰后进行过滤操作为了加快过滤速率不断用玻璃棒搅拌
c.若除锌时加入MnS质量为xg,沉锰反应中锰元素无损失,MnO2的产量将增加xg
 的工业废液,制备高纯的ZnO、MnO2、Fe2O3,设计出如下实验流程:
的工业废液,制备高纯的ZnO、MnO2、Fe2O3,设计出如下实验流程:
已知:①氢氧化锌沉淀呈白色
②氢氧化锰难溶于水
③溶液中金属离子沉淀完全时其浓度≤ 1×10-5mol/L
回答下列问题:
(1)向工业废液中加入双氧水,可能观察到的现象有:溶液的颜色发生变化和
(2)第一次调pH的目的是沉淀Fe3+。检验Fe3+是否完全沉淀的操作:取少量滤液于洁净试管中,最好加入下列试剂中的
a.稀氨水 b.KSCN溶液 c.K3Fe(CN)6溶液 d.溴水
(3)第二次调pH前,科研小组成员在室温下分析此时的溶液,得到相关数据见下表
| 浓度(mol/L) | 氢氧化物的Ksp | 开始沉淀的pH | 沉淀完全的pH | |
| Zn2+ | 0.12 | 1.2×10-17 | 6.0 | 8.1 |
| Mn2+ | 0.10 | 4.0×10-14 | 7.8 | 9.8 |
(4)已知常温下,Ksp(MnS)=3×10-14,Ksp(ZnS)=1.5×10-24,在除锌时发生沉淀转化反应为:MnS(s)+Zn2+(aq)
 ZnS(s)+Mn2+(aq),其平衡常数K
ZnS(s)+Mn2+(aq),其平衡常数K (5)沉锰反应在酸性条件下完成,写出反应的离子方程式
(6)下列关于沉锰制备高纯MnO2的说法中,不正确的是
a.若沉锰反应时加入足量浓盐酸并加热,MnO2的产率将降低
b.若沉锰后进行过滤操作为了加快过滤速率不断用玻璃棒搅拌
c.若除锌时加入MnS质量为xg,沉锰反应中锰元素无损失,MnO2的产量将增加xg
您最近一年使用:0次
3 . 硫氰[(SCN)2]是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
资料:①SCN-中S、C、N元素的化合价依次为:-2价、+4价、-3价。
②SCN-的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
③2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色)。
现有如下探究:
I.探究Cu2+对KSCN溶液检验Fe3+的影响:
(1)写出实验1中第i步的离子方程式___________ 。
甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。
该同学又继续进行如下实验
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________ 。
(3)由实验2、3可知,实验3中溶液变红的原因是___________ 。
资料:①SCN-中S、C、N元素的化合价依次为:-2价、+4价、-3价。
②SCN-的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
③2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色)。
现有如下探究:
I.探究Cu2+对KSCN溶液检验Fe3+的影响:
| 实验编号 | 操作 | 现象 |
| 实验1 | 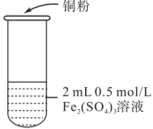 | i.加入Cu粉后充分振荡,溶液逐渐变蓝 ii.取少量i中清液于试管中,滴加2滴0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成 |
甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。
该同学又继续进行如下实验
| 实验编号 | 操作 | 现象 |
| 实验2 |  | 开始时溶液呈绿色,一段时间后开始出现白色沉淀,上层溶液变为黄色 |
| 实验3 | 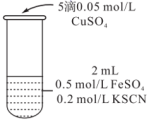 | 无色溶液立即变红,同时生成白色沉淀 |
(3)由实验2、3可知,实验3中溶液变红的原因是
您最近一年使用:0次
名校
解题方法
4 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
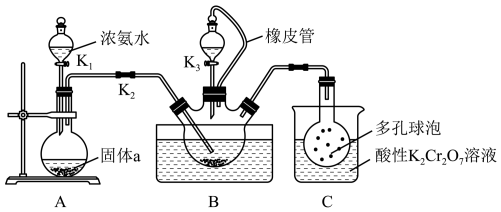
已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是___________ (填名称)。
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+3NH3 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且___________ 。
(3)一段时间后,当观察到三颈烧瓶内___________ 时,停止通入气体,反应完成。
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为___________ ;酸性K2Cr2O7溶液除可以吸收NH3外,还能吸收的气体是___________ 。
III.制备KSCN晶体
(5)先通过___________ (填实验操作名称)除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有___________ (填序号)。
①坩埚 ②蒸发皿 ③长颈漏斗 ④玻璃棒 ⑤烧杯 ⑥直形冷凝管
(6)测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取25.00mL溶液锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则指示剂的化学式为___________ (填序号)。
A.FeCl3 B.Fe(NO3)3 C.Fe2(SO4)3 D.Fe(SCN)3
②晶体中KSCN的质量分数为___________ (计算结果保留三位有效数字)。

已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+3NH3
 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且(3)一段时间后,当观察到三颈烧瓶内
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
III.制备KSCN晶体
(5)先通过
①坩埚 ②蒸发皿 ③长颈漏斗 ④玻璃棒 ⑤烧杯 ⑥直形冷凝管
(6)测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取25.00mL溶液锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则指示剂的化学式为
A.FeCl3 B.Fe(NO3)3 C.Fe2(SO4)3 D.Fe(SCN)3
②晶体中KSCN的质量分数为
您最近一年使用:0次
2021-12-22更新
|
1346次组卷
|
5卷引用:四川省成都市石室中学2021-2022学年高三上学期一诊考试化学试题
四川省成都市石室中学2021-2022学年高三上学期一诊考试化学试题湖南省衡阳市第八中学2022届高三上学期第五次月考化学试题(已下线)一轮巩固卷10-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)【直击双一流】01-备战2022年高考化学名校进阶模拟卷(通用版)广东广雅中学2022届高三下学期4月测试化学试题
5 . 以氟硅酸(制磷肥副产品)和电石灰为原料制备四氟化硅的一种工艺流程如图。已知电石灰主要成分为Ca(OH)2,还含有Al2O3、Fe2O3和SiO2等杂质。
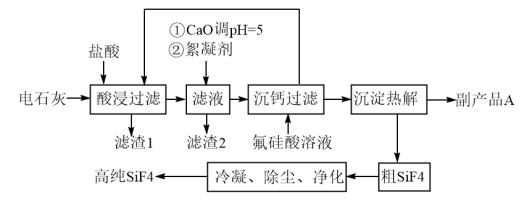
请回答下列问题:
(1)硅的某种核素含有16个中子,则该核素符号为___ 。沉钙过程中所加氟硅酸(H2SiF6)中硅元素的化合价为___ 。
(2)滤渣1的主要成分为___ (填化学式)。
(3)加入絮凝剂的目的为___ 。
(4)为检验“沉钙过滤”过程后的滤液中是否含有Fe3+,可选用的化学试剂是___ 。
(5)副产品A的化学式为___ ,上述流程中循环利用的物质为___ 。
(6)工业上可用碳酸钠溶液吸收SiF4,生成原硅酸(H4SiO4)和氟硅酸盐两种沉淀,写出该过程的化学方程式___ 。
(7)往CaCO3悬浊液中通入HF气体,也可以制得副产品A,写出该反应的离子反应方程式:___ 。(已知:25℃时,H2CO3的Ka1=4.5×10-7,Ka2=4.7×10-11;HF的Ka=6.3×10-4;Ksp(CaCO3)=3.4×10-9;Ksp(CaF2)=1.7×10-10)

请回答下列问题:
(1)硅的某种核素含有16个中子,则该核素符号为
(2)滤渣1的主要成分为
(3)加入絮凝剂的目的为
(4)为检验“沉钙过滤”过程后的滤液中是否含有Fe3+,可选用的化学试剂是
(5)副产品A的化学式为
(6)工业上可用碳酸钠溶液吸收SiF4,生成原硅酸(H4SiO4)和氟硅酸盐两种沉淀,写出该过程的化学方程式
(7)往CaCO3悬浊液中通入HF气体,也可以制得副产品A,写出该反应的离子反应方程式:
您最近一年使用:0次
6 . 根据下列实验操作和现象所得到的结论正确的是
| 操作 | 现象 | 结论 | |
| A | 将少量的硝酸铜受热分解(产物为CuO、NO2、O2)后的气体收集后,用带火星的木条检验 | 木条复燃 | NO2能支持燃烧 |
| B | 向2mL碘水中加入4mLCCl4振荡后静置 | 下层显紫红色 | I2在CCl4中溶解度大于在水中的溶解度 |
| C | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| D | 将铜粉加入1.0mol/L的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活泼 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 氧化锌在工业和生活中的运用非常广泛,以闪锌矿(主要成分为ZnS,含有少量FeS和SiO2)为原料制备活性氧化锌的工艺流程如图,请回答下列问题:

(1)矿渣中除了有淡黄色的物质,还有__ (填化学式)。
(2)加入铁粉的目的是__ ,能循环利用的无机物是__ (填化学式)。
(3)生成ZnCO3•2Zn(OH)2的离子方程式为__ 。
(4)有机萃取剂TBP能将氯化亚铁和氯化锌分离的原因是__ 。
(5)工业上常采用Fenton氧化法去除废水中的有机物,即向废水中加入H2O2,以FeCl2作催化剂,产生具有强氧化性的羟基自由基(•OH)来氧化降解水中的有机物(TOC)。
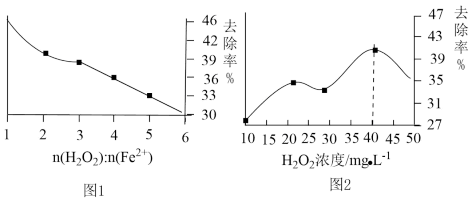
①其他条件一定时,n(H2O2):n(Fe2+)的值对TOC去除效果的影响如图1所示,当废水中TOC的去除率最大时,n(H2O2):n(Fe2+)=__ 。
②在酸性条件下,H2O2的加入量对TOC的去除效果如图2所示,当TOC的去除效果最好时,H2O2的物质的量浓度c(H2O2)=__ (保留三位有效数字)。

(1)矿渣中除了有淡黄色的物质,还有
(2)加入铁粉的目的是
(3)生成ZnCO3•2Zn(OH)2的离子方程式为
(4)有机萃取剂TBP能将氯化亚铁和氯化锌分离的原因是
(5)工业上常采用Fenton氧化法去除废水中的有机物,即向废水中加入H2O2,以FeCl2作催化剂,产生具有强氧化性的羟基自由基(•OH)来氧化降解水中的有机物(TOC)。

①其他条件一定时,n(H2O2):n(Fe2+)的值对TOC去除效果的影响如图1所示,当废水中TOC的去除率最大时,n(H2O2):n(Fe2+)=
②在酸性条件下,H2O2的加入量对TOC的去除效果如图2所示,当TOC的去除效果最好时,H2O2的物质的量浓度c(H2O2)=
您最近一年使用:0次
名校
8 . 固体混合物W由Cu、FeO、Fe2O3、SiO2、Na2CO3、K2SO4中的几种物质组成,进行以下实验:
下列说法正确的是
下列说法正确的是

| A.该固体中一定没有K2SO4 |
| B.溶液X中一定含有的阳离子为H+、Cu2+、Fe2+、Fe3+ |
| C.该固体W中一定含有Cu、Fe2O3、SiO2、Na2CO3 |
| D.固体W中,n(SiO2):n(Cu)≤4:3 |
您最近一年使用:0次
2021-12-02更新
|
992次组卷
|
4卷引用:黑龙江省哈尔滨市第九中学校2022届高三上学期适应性考试化学试题
黑龙江省哈尔滨市第九中学校2022届高三上学期适应性考试化学试题黑龙江省哈尔滨德强学校2021-2022学年高三上学期期中考试化学试题(已下线)【2023】【高一下】【其他】【杭二中-期中复习卷】【高中化学】【邵威宏收集】江苏省南京师大附中2023-2024学年高一下学期期中考试化学试卷
解题方法
9 . 高铁酸钠( )为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与
)为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与 溶液的反应制备
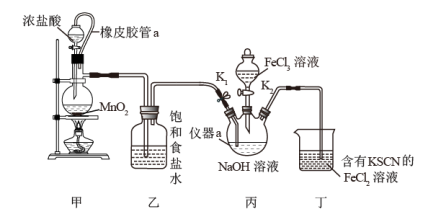
溶液的反应制备 并探究其性质,实验装置如下图所示。
并探究其性质,实验装置如下图所示。
请回答下列问题:
(1)橡皮管a的作用是___________ ,装置甲中反应的化学方程式为___________ 。
(2)若去掉装置乙,其不足之处为___________ 。
(3)当装置丁中出现___________ 现象时,关闭 ;此时向装置丙中加入
;此时向装置丙中加入 溶液。
溶液。
(4)装置丙中生成 的离子方程式为
的离子方程式为___________ 。
(5)反应后,向装置丙中加入饱和的___________ (填化学式)溶液,析出紫色晶体,过滤、洗涤、干燥。
(6)取少量 晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析
晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析 的净水原理为
的净水原理为___________ 。
 )为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与
)为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与 溶液的反应制备
溶液的反应制备 并探究其性质,实验装置如下图所示。
并探究其性质,实验装置如下图所示。
请回答下列问题:
(1)橡皮管a的作用是
(2)若去掉装置乙,其不足之处为
(3)当装置丁中出现
 ;此时向装置丙中加入
;此时向装置丙中加入 溶液。
溶液。(4)装置丙中生成
 的离子方程式为
的离子方程式为(5)反应后,向装置丙中加入饱和的
(6)取少量
 晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析
晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析 的净水原理为
的净水原理为
您最近一年使用:0次
名校
10 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃—5℃、碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
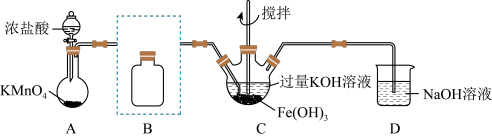
①装浓盐酸的仪器名称___________ 。
②将除杂装置B补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中Cl2发生的化学反应有: ,另外还有
,另外还有______ (写离子方程式):在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了 而产生Cl2,设计以下方案:
而产生Cl2,设计以下方案:
i.由方案I中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4将 氧化,还可能的原因
氧化,还可能的原因___________ 。
ii.方案II可证明K2FeO4氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________  (填“>”或“<”),而方案II实验表明,Cl2和
(填“>”或“<”),而方案II实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃—5℃、碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①装浓盐酸的仪器名称
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中Cl2发生的化学反应有:
 ,另外还有
,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了
 而产生Cl2,设计以下方案:
而产生Cl2,设计以下方案:| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
 氧化,还可能的原因
氧化,还可能的原因ii.方案II可证明K2FeO4氧化了
 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和
(填“>”或“<”),而方案II实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2021-10-27更新
|
598次组卷
|
2卷引用:内蒙古通辽和市赤峰市部分学校联考2021-2022学年高三上学期10月联考质量检测化学试题



