名校
解题方法
1 . 实验小组探究外界因素对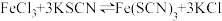 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,得到红色混合溶液。已知该混合溶液中存在与
溶液等体积混合,得到红色混合溶液。已知该混合溶液中存在与 相关的反应有:
相关的反应有:
I.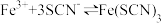
II.
(1)①若往混合溶液中加入少量的 固体,平衡
固体,平衡_______ (填“正向”、“逆向”、“不”)移动;
②若往混合溶液中加入少量的 固体,平衡
固体,平衡_______ (填“正向”、“逆向”、“不”)移动。
(2)某同学认为往平衡体系中加入酸后,会使反应I体系中_______ 增大,导致该平衡正向移动,溶液颜色加深。
设计实验进行验证。取两等份红色溶液,进行如下操作并记录现象。
【查阅资料】 和
和 、
、 均能发生络合反应:
均能发生络合反应:
III. (黄色)
(黄色)
IV. (无色)
(无色)
实验:探究现象a中溶液颜色变化的原因。
(3)实验①的目的是_______ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:_______ 。
实验:探究现象b中溶液显浅黄色的原因。
(5)由实验③可知,溶液变为浅黄色与_______ (填微粒的化学式)无关。
(6)为了进一步确证现象b中使溶液呈浅黄色的微粒只是 ,补充完整实验④的操作及现象。操作:
,补充完整实验④的操作及现象。操作:_______ 。现象:_______ 。
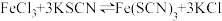 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,得到红色混合溶液。已知该混合溶液中存在与
溶液等体积混合,得到红色混合溶液。已知该混合溶液中存在与 相关的反应有:
相关的反应有:I.
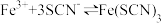
II.

(1)①若往混合溶液中加入少量的
 固体,平衡
固体,平衡②若往混合溶液中加入少量的
 固体,平衡
固体,平衡(2)某同学认为往平衡体系中加入酸后,会使反应I体系中
设计实验进行验证。取两等份红色溶液,进行如下操作并记录现象。
 现象a:溶液颜色变浅,呈橙色 |  现象b:溶液变为浅黄色 |
 和
和 、
、 均能发生络合反应:
均能发生络合反应:III.
 (黄色)
(黄色) IV.
 (无色)
(无色)实验:探究现象a中溶液颜色变化的原因。
| 编号 | 操作 | 现象 |
| ① | 向 红色溶液中滴加15滴水 红色溶液中滴加15滴水 | 溶液颜色无明显变化 |
| ② | 向 红色溶液中滴加5滴 红色溶液中滴加5滴 溶液 溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验:探究现象b中溶液显浅黄色的原因。
| 编号 | 操作 | 现象 |
| ③ | 取 溶液(无色)。加入 溶液(无色)。加入 溶液,再加入5滴 溶液,再加入5滴 溶液。 溶液。 | 溶液先变红,加硫酸后变为浅黄色。 |
| ④ | 取 溶液(无色), 溶液(无色), |
(6)为了进一步确证现象b中使溶液呈浅黄色的微粒只是
 ,补充完整实验④的操作及现象。操作:
,补充完整实验④的操作及现象。操作:
您最近一年使用:0次
2 . 某小组同学探究 与
与 溶液的反应。
溶液的反应。
(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备 ,将
,将 通入
通入 溶液中。
溶液中。 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。
①浓 与Cu反应的化学方程式是
与Cu反应的化学方程式是_______ 。
②试剂a是_______ 。
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是_______ 。(写离子方程式)。
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与 、
、 有关。
有关。
假设2:主要与 、
、 有关。
有关。
实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向 溶液中加入
溶液中加入 溶液,
溶液,_______ (填现象),然后滴加_______ (填试剂),溶液变为黄色。
(3)进一步探究 与
与 、
、 显红棕色的原因。
显红棕色的原因。
查阅资料: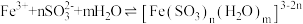 (红棕色)
(红棕色)
实验Ⅲ:向 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
甲同学认为橙黄色沉淀中可能含有 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是_______ 。
②实验证实橙黄色沉淀中含有 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是_______ 、_______ 。
(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是_______ 。
 与
与 溶液的反应。
溶液的反应。(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备
 ,将
,将 通入
通入 溶液中。
溶液中。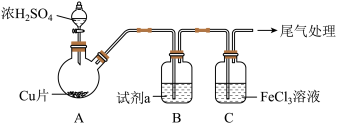
 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。①浓
 与Cu反应的化学方程式是
与Cu反应的化学方程式是②试剂a是
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与
 、
、 有关。
有关。假设2:主要与
 、
、 有关。
有关。实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向
 溶液中加入
溶液中加入 溶液,
溶液,(3)进一步探究
 与
与 、
、 显红棕色的原因。
显红棕色的原因。查阅资料:
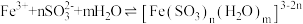 (红棕色)
(红棕色)实验Ⅲ:向
 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。甲同学认为橙黄色沉淀中可能含有
 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。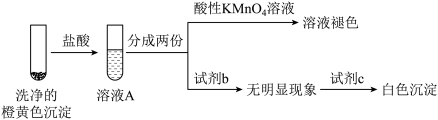
 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是②实验证实橙黄色沉淀中含有
 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是
您最近一年使用:0次
2022-11-04更新
|
689次组卷
|
6卷引用:北京市朝阳区2022-2023学年高三上学期期中考试化学试题
名校
解题方法
3 . 某小组欲探究反应2Fe2++I2 2Fe3++2I—,完成如下实验:
2Fe3++2I—,完成如下实验:
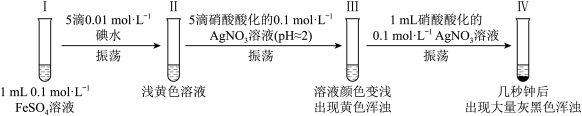
资料:AgI是黄色固体,不溶于稀硝酸;新制的AgI见光会少量分解。
一、经检验,I、II中均无 ,III中含
,III中含 。
。
(1)II中未检出 的实验操作及现象是:取少量Ⅱ中溶液,
的实验操作及现象是:取少量Ⅱ中溶液,___________ 。
(2)III中的黄色浑浊是___________ 。
(3)研究III中 产生的原因
产生的原因
①甲同学对此做出如下假设:
假设a:空气中存在 ,由于
,由于___________ (用离子方程式表示),可产生 ;
;
假设b:酸性溶液中___________ (填化学式)具有氧化性,可产生 ;
;
假设c:溶液中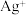 具有氧化性,可产生
具有氧化性,可产生 ;
;
通过实验证实a、b、c不是产生 的主要原因,实验方案和现象是
的主要原因,实验方案和现象是___________ 。
②进一步实验表明,产生 时的氧化剂是
时的氧化剂是 ,从物质性质的角度分析
,从物质性质的角度分析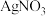 溶液作用是
溶液作用是___________ 。
二、继续研究III→IV过程中出现灰黑色浑浊的原因:
(4)完成如下实验:
实验1:检验出IV中灰黑色浑浊中含有AgI和Ag。验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,___________ 。
实验2:向1mL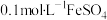 溶液中加入1mL
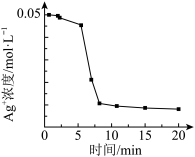
溶液中加入1mL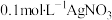 溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中
溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中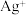 浓度随反应时间的变化如下图。
浓度随反应时间的变化如下图。
实验3:实验开始时,先向试管中加入几滴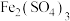 溶液,重复实验2,实验结果与实验2相同。
溶液,重复实验2,实验结果与实验2相同。
①实验2中发生反应的离子方程式是___________ 。
②IV中迅速出现灰黑色浑浊的可能的原因是___________ 。
 2Fe3++2I—,完成如下实验:
2Fe3++2I—,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸;新制的AgI见光会少量分解。
一、经检验,I、II中均无
 ,III中含
,III中含 。
。(1)II中未检出
 的实验操作及现象是:取少量Ⅱ中溶液,
的实验操作及现象是:取少量Ⅱ中溶液,(2)III中的黄色浑浊是
(3)研究III中
 产生的原因
产生的原因①甲同学对此做出如下假设:
假设a:空气中存在
 ,由于
,由于 ;
;假设b:酸性溶液中
 ;
;假设c:溶液中
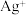 具有氧化性,可产生
具有氧化性,可产生 ;
;通过实验证实a、b、c不是产生
 的主要原因,实验方案和现象是
的主要原因,实验方案和现象是②进一步实验表明,产生
 时的氧化剂是
时的氧化剂是 ,从物质性质的角度分析
,从物质性质的角度分析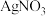 溶液作用是
溶液作用是二、继续研究III→IV过程中出现灰黑色浑浊的原因:
(4)完成如下实验:
实验1:检验出IV中灰黑色浑浊中含有AgI和Ag。验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,
实验2:向1mL
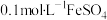 溶液中加入1mL
溶液中加入1mL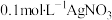 溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中
溶液,开始时,溶液无明显变化,几分钟后,出现大量灰黑色浑浊,反应过程中温度几乎无变化,测定溶液中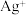 浓度随反应时间的变化如下图。
浓度随反应时间的变化如下图。
实验3:实验开始时,先向试管中加入几滴
 溶液,重复实验2,实验结果与实验2相同。
溶液,重复实验2,实验结果与实验2相同。①实验2中发生反应的离子方程式是
②IV中迅速出现灰黑色浑浊的可能的原因是
您最近一年使用:0次
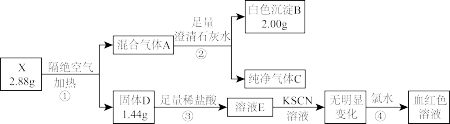
4 . 化合物X由四种元素组成,某实验小组按如下流程进行相关实验。
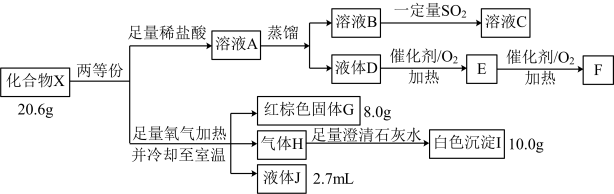
已知:J能使无水硫酸铜变蓝,上述物质中E和F能发生银镜反应。请回答:
(1)组成X的四种元素为_______ 。
(2)溶液A的溶质组成为_______ (用化学式表示)。
(3)写出 的化学方程式
的化学方程式_______ 。
(4)X可溶于HI溶液中,写出反应的离子方程式_______ 。
(5)设计实验,检验溶液C中可能的金属阳离子_______ 。

已知:J能使无水硫酸铜变蓝,上述物质中E和F能发生银镜反应。请回答:
(1)组成X的四种元素为
(2)溶液A的溶质组成为
(3)写出
 的化学方程式
的化学方程式(4)X可溶于HI溶液中,写出反应的离子方程式
(5)设计实验,检验溶液C中可能的金属阳离子
您最近一年使用:0次
5 . 硫酸亚铁在印染、医药、化肥等多个行业有广泛应用。某学习小组对硫酸亚铁晶体 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
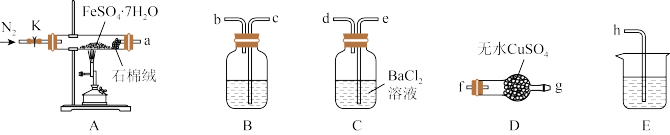
(1)装置A中石棉绒的作用为__________ 。
(2)按气流方向,上述装置合理的连接顺序为a→f、g→_____ →h(填装置口小写字母)。
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
(4)硫酸亚铁晶体分解的化学方程式为_________ 。
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:_______ (简述实验操作及现象)。
 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
(1)装置A中石棉绒的作用为
(2)按气流方向,上述装置合理的连接顺序为a→f、g→
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
| 装置编号 | 填装试剂 | 实验现象 | 实验结论 |
| A | FeSO4·7H2O | 绿色固体逐渐变为红色粉末 | — |
| B | ① | ② | 分解产物中含有SO2 |
| C | BaCl2溶液 | 产生白色沉淀 | ③ |
| D | 无水CuSO4粉末 | 白色固体逐渐变为蓝色 | 分解产物中含有水蒸气 |
| E | ④ | — | — |
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:
您最近一年使用:0次
2022-08-13更新
|
166次组卷
|
2卷引用:福建省福安市第一中学2023届高三上学期第一次检测化学试题
6 . Fe3+的配位化合物较稳定且应用广泛。Fe3+可与H2O、SCN-、F-等配体形成使溶液呈浅紫色的[Fe(H2O)6]3+、红色的[Fe(SCN)6]3-、无色的[FeF6]3-配离子。某同学按如下步骤完成实验:
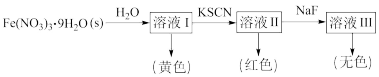
| A.Fe第四电离能(I4)大于其第三电离能(I3) |
| B.Ⅰ中溶液呈黄色可能是由Fe3+水解产物的颜色造成 |
| C.可用NaF和KSCN溶液检验FeCl3溶液中是否含有Co2+ |
| D.[Fe(H2O)6]3+中H-O-H的键角与H2O分子中H-O-H的键角相等 |
您最近一年使用:0次
2022-07-17更新
|
455次组卷
|
5卷引用:北京顺义区2021-2022学年高二下学期期末考试化学试题
北京顺义区2021-2022学年高二下学期期末考试化学试题(已下线)期中模拟预测卷02(测试范围:选择性必修2+选择性必修3第1章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)天津市第二十中学2022-2023学年高二下学期期中考试化学试题广西百色市2022-2023学年高二下学期期末考试化学试题(已下线)题型突破01 有机实验(选择题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
7 . 用相同浓度的 和
和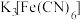 溶液进行实验:
溶液进行实验:不正确 的是
 和
和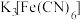 溶液进行实验:
溶液进行实验: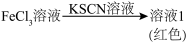

A.相同浓度的 和 和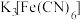 溶液中, 溶液中, 的浓度不同 的浓度不同 |
B. 提供空轨道, 提供空轨道, 提供孤电子对,两者以配位键结合成 提供孤电子对,两者以配位键结合成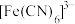 |
C.溶液2不显红色,说明 与 与 的结合力强于与 的结合力强于与 的结合力 的结合力 |
D.由对比实验可知,用 溶液检验 溶液检验 溶液中的 溶液中的 比用KSCN溶液更好 比用KSCN溶液更好 |
您最近一年使用:0次
2022-07-10更新
|
1025次组卷
|
6卷引用:北京朝阳区2021-2022学年高二下学期期末质量抽测化学试题
北京朝阳区2021-2022学年高二下学期期末质量抽测化学试题(已下线)第15讲 铁盐和亚铁盐(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)铁 金属材料——课时2 铁盐和亚铁盐广东省中山市2022-2023学年高二下学期期末统一考试化学试题安徽省合肥市六校联盟2023-2024学年高二下学期期中联考 化学试题(已下线)题型突破01 有机实验(选择题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
8 . 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
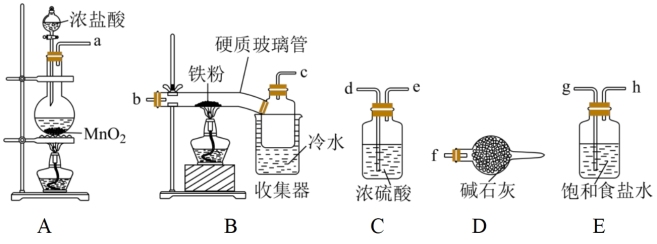
(1)装置接口的连接顺序为a→_______ 。
(2)B中收集器里盛放冷水的作用是_______ 。D中碱石灰的作用是_______ 、_______ 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸,充分反应后,进行如下实验:
固体混合物 淡黄色溶液
淡黄色溶液 淡红色溶液
淡红色溶液 深红色溶液
深红色溶液 红色褪去
红色褪去
①试剂X为_______ (填化学式)。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是_______ 。
(4)该小组同学对上述溶液红色褪去的原因进行探究。
①取褪色后的溶液三份,分别进行以下实验,研究溶液中存在的微粒。
a.一份中滴加FeCl3溶液无明显变化,说明_______ ;
b.另一份滴加试剂X,溶液出现红色,说明_______ ;
c.还有一份滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明_______ 。
②另取FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。实验②的目的是_______ ;得出结论:_______ 。

(1)装置接口的连接顺序为a→
(2)B中收集器里盛放冷水的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸,充分反应后,进行如下实验:
固体混合物
 淡黄色溶液
淡黄色溶液 淡红色溶液
淡红色溶液 深红色溶液
深红色溶液 红色褪去
红色褪去①试剂X为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是
(4)该小组同学对上述溶液红色褪去的原因进行探究。
①取褪色后的溶液三份,分别进行以下实验,研究溶液中存在的微粒。
a.一份中滴加FeCl3溶液无明显变化,说明
b.另一份滴加试剂X,溶液出现红色,说明
c.还有一份滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明
②另取FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。实验②的目的是
您最近一年使用:0次
2022-07-02更新
|
1041次组卷
|
3卷引用:上海市控江中学2021-2022学年高一下学期期末考试化学试题
9 . 化合物X(含3种常见元素)可用作照相显影剂。对X开展探究实验如图:
请回答:
(1)组成X的3种元素是_______ (填元素符号),白色沉淀B的化学式是_______ 。
(2)X隔绝空气受热分解的化学方程式_______ 。
(3)已知固体D不稳定,在空气中受热易迅速被氧化为磁性固体。甲同学认为磁性固体为_______ ,发生的化学方程式为_______ 。
(4)某同学在步骤④时,逐滴滴入氯水直至过量,结果出现的血红色又重新褪去,请说明可能的原因_______ 。

请回答:
(1)组成X的3种元素是
(2)X隔绝空气受热分解的化学方程式
(3)已知固体D不稳定,在空气中受热易迅速被氧化为磁性固体。甲同学认为磁性固体为
(4)某同学在步骤④时,逐滴滴入氯水直至过量,结果出现的血红色又重新褪去,请说明可能的原因
您最近一年使用:0次
名校
解题方法
10 . 实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
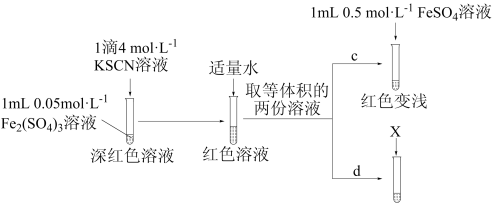
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应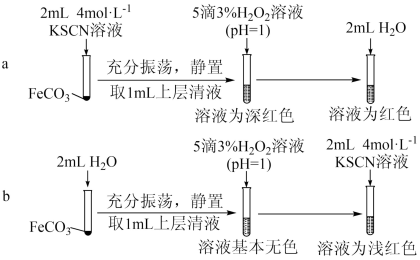
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
2022-05-30更新
|
1318次组卷
|
11卷引用:北京市东城区2022届高三综合练习(二模)化学试题
北京市东城区2022届高三综合练习(二模)化学试题北京市育才学校2022届高三下学期三模化学试题北京市一零一中学2022届高三三模化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市北京一零一中学2022-2023学年高三上学期统练7化学试题北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)实验探究题北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题北京大学附属中学预科部2023-2024学年高三上学期12月阶段练习化学试题



