名校
解题方法
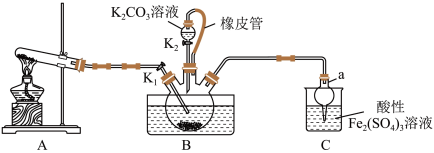
1 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至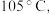 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知 (白色)]:
(白色)]:___________ [可供选择的试剂: 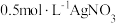 溶液、
溶液、 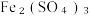 溶液、
溶液、 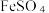 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
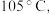 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
 (白色)]:
(白色)]: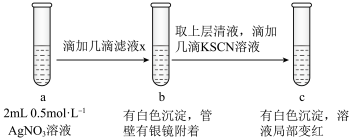
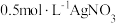 溶液、
溶液、 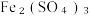 溶液、
溶液、 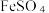 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
2024-04-16更新
|
269次组卷
|
2卷引用:福建师范大学附属中学2021-2022学年高一下学期期末考试化学试题
2 . 石墨在材料领域有重要应用,某初级石墨中含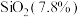 、
、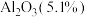 和
和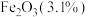 等杂质,提纯与综合利用工艺流程如下:
等杂质,提纯与综合利用工艺流程如下:
② 的沸点为57.6℃,金属氯化物的沸点均高于150℃.
的沸点为57.6℃,金属氯化物的沸点均高于150℃.
(1)“氯化”时,先向反应器中通入 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是______ 。
(2)“冷凝”后,所得“气体”的成分有 和
和______ (填化学式)。
(3)“溶解过滤”时,加过量NaOH溶液的目的是______ ;取少量滤液于试管中,______ (实验操作及现象),证明已完全沉淀。
(4)“沉铝”得到的产物为 ,工业上由
,工业上由 制Al需发生两步反应,写出第一步得到
制Al需发生两步反应,写出第一步得到 的化学方程式
的化学方程式______ 。
(5)写出A1的一种用途______ 。
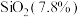 、
、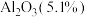 和
和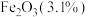 等杂质,提纯与综合利用工艺流程如下:
等杂质,提纯与综合利用工艺流程如下:
②
 的沸点为57.6℃,金属氯化物的沸点均高于150℃.
的沸点为57.6℃,金属氯化物的沸点均高于150℃.(1)“氯化”时,先向反应器中通入
 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是(2)“冷凝”后,所得“气体”的成分有
 和
和(3)“溶解过滤”时,加过量NaOH溶液的目的是
(4)“沉铝”得到的产物为
 ,工业上由
,工业上由 制Al需发生两步反应,写出第一步得到
制Al需发生两步反应,写出第一步得到 的化学方程式
的化学方程式(5)写出A1的一种用途
您最近一年使用:0次
名校
解题方法
3 . 四氧化三铁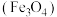 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
(1)中国科学院上海硅酸盐研究所研制出“纳米药物分子运输车”,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法正确的是___________。
(2)① 能和稀硫酸反应,写出反应的离子方程式
能和稀硫酸反应,写出反应的离子方程式___________ 。
②验证反应后溶液中含有 的最恰当的试剂是
的最恰当的试剂是___________ 。
A.氯水 B.酸性高锰酸钾溶液 C.硫氰化钾溶液 D. 溶液
溶液
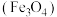 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。(1)中国科学院上海硅酸盐研究所研制出“纳米药物分子运输车”,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法正确的是___________。

| A.该“运输车”中四氧化三铁和二氧化硅都属于氧化物 |
| B.四氧化三铁起到“磁性导航仪”的作用 |
| C.该“运输车”属于混合物 |
| D.该“运输车”分散于水中所得的分散系属于胶体 |
 能和稀硫酸反应,写出反应的离子方程式
能和稀硫酸反应,写出反应的离子方程式②验证反应后溶液中含有
 的最恰当的试剂是
的最恰当的试剂是A.氯水 B.酸性高锰酸钾溶液 C.硫氰化钾溶液 D.
 溶液
溶液
您最近一年使用:0次
名校
解题方法
4 . 明矾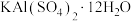 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
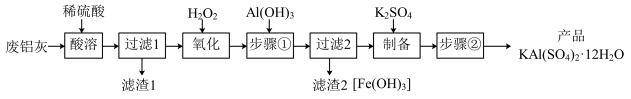
已知: 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
(1)“酸溶”时, 溶解的离子方程式为
溶解的离子方程式为_____ 。
(2)“氧化”时,发生反应的离子方程式为_____ 。
(3)“步骤①”调节pH约为3.7的目的是_____ ;检验“过滤2”滤液中是否含 可用试剂
可用试剂_____ 。
(4)“步骤②”包含的操作有_____ 、_____ 、过滤、洗涤及干燥。
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾_____ kg。
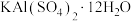 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
已知:
 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。(1)“酸溶”时,
 溶解的离子方程式为
溶解的离子方程式为(2)“氧化”时,发生反应的离子方程式为
(3)“步骤①”调节pH约为3.7的目的是
 可用试剂
可用试剂(4)“步骤②”包含的操作有
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾
您最近一年使用:0次
5 . 硫酸亚铁铵 又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含
又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含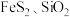 等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下:
等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下: 中S元素的化合价为
中S元素的化合价为_______ ;
(2)在焙烧前通常将黄铁矿粉碎,其目的是_______ ;焙烧的主要反应化学方程式是_______ ;
(3)滤渣1的主要成分是_______ ;
(4)为证实所得莫尔盐样品中不含 ,实验方案为:取其少量样品溶于试管中,加入
,实验方案为:取其少量样品溶于试管中,加入_______ (填化学式),现象是_______ ,证明不含 ;
;
(5)吸收 气体时用98.3%的浓硫酸而不用水,原因是
气体时用98.3%的浓硫酸而不用水,原因是_______ ;
(6)硫酸工厂的尾气中仍含有一定量 ,可用氨碱法进行处理。用过量氨水吸收
,可用氨碱法进行处理。用过量氨水吸收 的离子方程式为
的离子方程式为_______ 。
 又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含
又称莫尔盐,是一种重要的化工原料,用途十分广泛。可用黄铁矿(主要含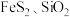 等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下:
等)制备莫尔盐,该过程中产生的废气同时也可用于工业制硫酸,流程如下:
 中S元素的化合价为
中S元素的化合价为(2)在焙烧前通常将黄铁矿粉碎,其目的是
(3)滤渣1的主要成分是
(4)为证实所得莫尔盐样品中不含
 ,实验方案为:取其少量样品溶于试管中,加入
,实验方案为:取其少量样品溶于试管中,加入 ;
;(5)吸收
 气体时用98.3%的浓硫酸而不用水,原因是
气体时用98.3%的浓硫酸而不用水,原因是(6)硫酸工厂的尾气中仍含有一定量
 ,可用氨碱法进行处理。用过量氨水吸收
,可用氨碱法进行处理。用过量氨水吸收 的离子方程式为
的离子方程式为
您最近一年使用:0次
名校
6 .  .绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
.绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
为探究硫酸亚铁的分解产物,将绿矾加热失去结晶水至恒重,将所得固体置于装置A接入下图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。___________ 、玻璃棒、酒精灯。
(2)①C、D中的溶液依次为___________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为___________ 。
a.品红 b. c.
c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式___________ 。
 .工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示:
.工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示: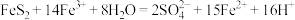
(3)① 的电子式为
的电子式为___________ 。
②过程 反应的离子方程式为
反应的离子方程式为___________ 。
③脱硫过程中产生的 在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是
在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是___________ (用离子方程式表示)。
(4)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: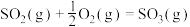
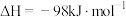 。钒催化剂参与反应的能量变化如图所示,
。钒催化剂参与反应的能量变化如图所示,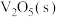 与
与 反应生成
反应生成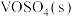 和
和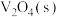 的热化学方程为:
的热化学方程为:___________ 。
 .绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
.绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:为探究硫酸亚铁的分解产物,将绿矾加热失去结晶水至恒重,将所得固体置于装置A接入下图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。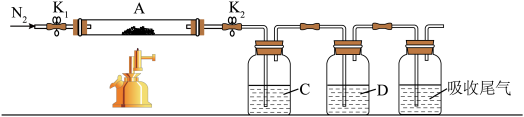
(2)①C、D中的溶液依次为
a.品红 b.
 c.
c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式
 .工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示:
.工业上利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫的过程如下图所示: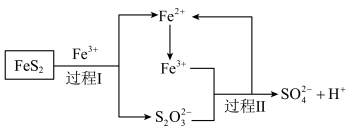
(3)①
 的电子式为
的电子式为②过程
 反应的离子方程式为
反应的离子方程式为③脱硫过程中产生的
 在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是
在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是(4)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: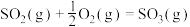
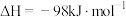 。钒催化剂参与反应的能量变化如图所示,
。钒催化剂参与反应的能量变化如图所示,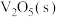 与
与 反应生成
反应生成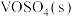 和
和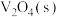 的热化学方程为:
的热化学方程为: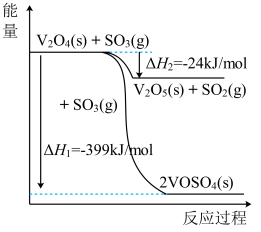
您最近一年使用:0次
解题方法
7 . 钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
① 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是___________ 。
② 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是___________ (填“还原产物”或“氧化产物”)。
(2)铁及其重要化合物之间的部分转化关系如图所示。___________ (填序号);
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
②实现Fe转化为Fe2+可选用足量的___________ (填序号);
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
③在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为血红色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为___________ 。
④在FeSO4中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为___________ ,此过程中发生的氧化还原反应为(用化学方程式表达)___________ 。
(1)某汽车安全气囊的产气药剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。①
 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是②
 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是(2)铁及其重要化合物之间的部分转化关系如图所示。
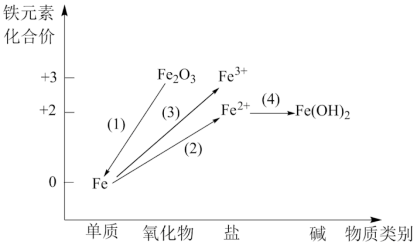
a.金红石(TiO2) b.赤铁矿(Fe2O3) c.辉铜矿(Cu2S)
②实现Fe转化为Fe2+可选用足量的
a.稀盐酸 b.氢氧化钠溶液 c.稀硝酸
③在点燃的条件下,Fe与足量Cl2剧烈反应后,将产物溶于水,再滴加KSCN溶液,则溶液变为血红色,证明产物为FeCl3,写出氯气和铁反应的化学方程式为
④在FeSO4中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
您最近一年使用:0次
名校
解题方法
8 . SO2是硫元素中一种重要物质。在生产生活中有着重要用途。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。_____ 。根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
a.请设计实验方案检验溶液中是否还有Fe3+:_____ 。
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_____ (填“合理”或“不合理”),理由是_____ 。
②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有_____ (填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)_____ 。
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是_____ (用离子方程式表示)。
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是_____ 。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
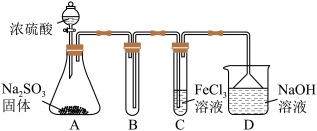
a.请设计实验方案检验溶液中是否还有Fe3+:
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)
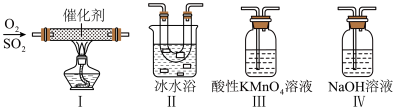
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是
您最近一年使用:0次
2024-04-03更新
|
271次组卷
|
2卷引用:重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
9 . 将下列有关铁及其化合物的性质或用途的字母序号与所对应的物质对应起来:
A.具有磁性的黑色固体;B.用于治疗缺铁性贫血;C.涂料中的红色颜料;D.用于保存亚铁盐溶液;E.在空气中很不稳定;F.遇KSCN溶液变色
(1)铁单质
(2)三氧化二铁
(3)四氧化三铁
(4)氢氧化亚铁
(5)亚铁盐
(6)铁盐
您最近一年使用:0次
解题方法
10 . 纳米磁性 在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性
在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性 的工艺流程如下:
的工艺流程如下: 溶于强碱时生成
溶于强碱时生成 。
。
(1)“碱洗”废旧镀锌铁皮的目的是___________(填字母)。
(2)“酸溶”后的溶液中阳离子主要有___________ 。
(3)“氧化”时发生的总反应离子方程式为___________ 。在酸性条件下, 很容易发生反应:
很容易发生反应: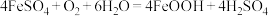 。为避免生成
。为避免生成 影响产品纯度,则“氧化”时应选择的加料方式为
影响产品纯度,则“氧化”时应选择的加料方式为___________ 。
(4)“氧化”后溶液中 的物质的量之比是1∶2,检验其中
的物质的量之比是1∶2,检验其中 可选用的试剂是___________。
可选用的试剂是___________。
(5)“分离”时 纳米粒子不能采用过滤法实现固液分离,理由是
纳米粒子不能采用过滤法实现固液分离,理由是___________ 。
(6)用重铬酸钾法(一种氧化还原滴定法)可测定产物 中的二价铁含量。若需配制浓度为
中的二价铁含量。若需配制浓度为 的
的 标准溶液
标准溶液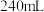 ,应准确称取
,应准确称取___________ g (保留4位有效数字,已知
(保留4位有效数字,已知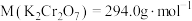 )。
)。
 在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性
在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性 的工艺流程如下:
的工艺流程如下:
 溶于强碱时生成
溶于强碱时生成 。
。(1)“碱洗”废旧镀锌铁皮的目的是___________(填字母)。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化铁皮 |
(2)“酸溶”后的溶液中阳离子主要有
(3)“氧化”时发生的总反应离子方程式为
 很容易发生反应:
很容易发生反应: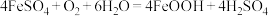 。为避免生成
。为避免生成 影响产品纯度,则“氧化”时应选择的加料方式为
影响产品纯度,则“氧化”时应选择的加料方式为(4)“氧化”后溶液中
 的物质的量之比是1∶2,检验其中
的物质的量之比是1∶2,检验其中 可选用的试剂是___________。
可选用的试剂是___________。A. 溶液 溶液 | B. 溶液 溶液 | C.酸性 溶液 溶液 | D. |
(5)“分离”时
 纳米粒子不能采用过滤法实现固液分离,理由是
纳米粒子不能采用过滤法实现固液分离,理由是(6)用重铬酸钾法(一种氧化还原滴定法)可测定产物
 中的二价铁含量。若需配制浓度为
中的二价铁含量。若需配制浓度为 的
的 标准溶液
标准溶液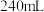 ,应准确称取
,应准确称取 (保留4位有效数字,已知
(保留4位有效数字,已知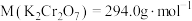 )。
)。
您最近一年使用:0次



