名校
解题方法
1 . 二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点—105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________ 。写出SOCl2吸收水蒸气的化学方程式:_______________________________ 。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。
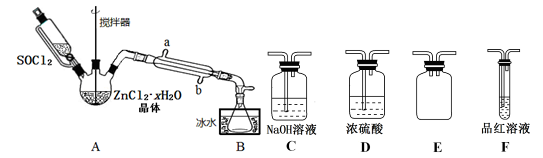
①装置的连接顺序为A→B→____ →___ →___ →____ 。
②冷凝管的进水口是_______________ 。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若 =
=___ (保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________ 。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________ 或______________ (填离子符号)是否存在证明该过程是否发生了氧化还原反应。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→
②冷凝管的进水口是
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若
 =
=④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明
您最近一年使用:0次
名校
解题方法
2 . 硫脲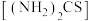 称为硫代尿素,它是制造磺胺药物的原料,用于合成抗甲状腺功能亢进药物等。150℃时硫脲部分异构化为
称为硫代尿素,它是制造磺胺药物的原料,用于合成抗甲状腺功能亢进药物等。150℃时硫脲部分异构化为 ,硫脲能溶于水和乙醇,但不溶于乙醚等有机溶剂。一种制备硫脲的新工艺如图所示。反应原理:
,硫脲能溶于水和乙醇,但不溶于乙醚等有机溶剂。一种制备硫脲的新工艺如图所示。反应原理: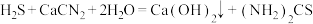 。
。
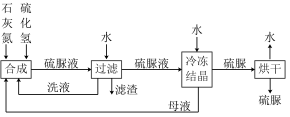
回答下列问题:
(1)“过滤”获得滤渣的主要成分是___________ (填化学式)。
(2)“合成”时,在反应釜中加入石灰氮 和水,边搅拌边通入
和水,边搅拌边通入 ,这样操作的目的是
,这样操作的目的是___________ 。洗液、母液循环回收于“合成”工序,这样操作的目的是___________ 。
(3)宜选择下列试剂___________ 洗涤“硫脲”晶体(填字母)。
A.水 B.75%酒棈 C.乙醚
(4)尿素、硫脲、聚乙烯醇熔融生成固体电解质(SPE)。用丙酮作溶剂(导电性很弱),浸取SPE得到丙酮浸出液并进行如下实验:
①向浸出液中滴加1%盐酸,测得溶液导电率与盐酸浓度关系如图所示。

实验结果发现:CD段产生沉淀质量最大,用元素分析仪测定该沉淀仅含氮、氢、氯三种元素,进一步实验发现,该沉淀有固定嫆点,与氢氧化钠浓溶液共热产生一种能使湿润的红色石蕊试纸变蓝色的气体,由此推知,产生沉淀的成分是___________ (填化学式);BC段导电率降低的主要原因是___________ 。
②向分离沉淀后的剩余溶液中滴加 溶液,溶液变为
溶液,溶液变为___________ 色,说明固体电解质导电阴离子可能是 。
。
(5)测定固体电解质(SPE)中 含量。称取wg样品溶于水(没有发生化学变化),滴加2~3滴
含量。称取wg样品溶于水(没有发生化学变化),滴加2~3滴 溶液,用
溶液,用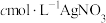 溶液滴定至终点,消耗滴定液的体积为VmL。
溶液滴定至终点,消耗滴定液的体积为VmL。
①则该SPE含 的质量分数为
的质量分数为___________ %。
②如果先加热熔化SPE,再测得 含量,测得结果
含量,测得结果___________ (填“偏高”“偏低”或“无影响”)。已知:滴定反应为 。
。
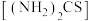 称为硫代尿素,它是制造磺胺药物的原料,用于合成抗甲状腺功能亢进药物等。150℃时硫脲部分异构化为
称为硫代尿素,它是制造磺胺药物的原料,用于合成抗甲状腺功能亢进药物等。150℃时硫脲部分异构化为 ,硫脲能溶于水和乙醇,但不溶于乙醚等有机溶剂。一种制备硫脲的新工艺如图所示。反应原理:
,硫脲能溶于水和乙醇,但不溶于乙醚等有机溶剂。一种制备硫脲的新工艺如图所示。反应原理: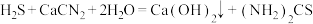 。
。
回答下列问题:
(1)“过滤”获得滤渣的主要成分是
(2)“合成”时,在反应釜中加入石灰氮
 和水,边搅拌边通入
和水,边搅拌边通入 ,这样操作的目的是
,这样操作的目的是(3)宜选择下列试剂
A.水 B.75%酒棈 C.乙醚
(4)尿素、硫脲、聚乙烯醇熔融生成固体电解质(SPE)。用丙酮作溶剂(导电性很弱),浸取SPE得到丙酮浸出液并进行如下实验:
①向浸出液中滴加1%盐酸,测得溶液导电率与盐酸浓度关系如图所示。

实验结果发现:CD段产生沉淀质量最大,用元素分析仪测定该沉淀仅含氮、氢、氯三种元素,进一步实验发现,该沉淀有固定嫆点,与氢氧化钠浓溶液共热产生一种能使湿润的红色石蕊试纸变蓝色的气体,由此推知,产生沉淀的成分是
②向分离沉淀后的剩余溶液中滴加
 溶液,溶液变为
溶液,溶液变为 。
。(5)测定固体电解质(SPE)中
 含量。称取wg样品溶于水(没有发生化学变化),滴加2~3滴
含量。称取wg样品溶于水(没有发生化学变化),滴加2~3滴 溶液,用
溶液,用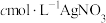 溶液滴定至终点,消耗滴定液的体积为VmL。
溶液滴定至终点,消耗滴定液的体积为VmL。①则该SPE含
 的质量分数为
的质量分数为②如果先加热熔化SPE,再测得
 含量,测得结果
含量,测得结果 。
。
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
3 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
名校
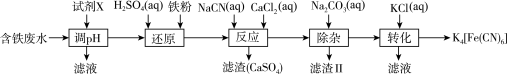
4 . 亚铁氰化钾 是一种黄色颜料。以含铁废水[主要成分为
是一种黄色颜料。以含铁废水[主要成分为 ,含少量
,含少量 、
、 等]为原料合成亚铁氰化钾的工艺流程如下:
等]为原料合成亚铁氰化钾的工艺流程如下:
下列说法错误的是
 是一种黄色颜料。以含铁废水[主要成分为
是一种黄色颜料。以含铁废水[主要成分为 ,含少量
,含少量 、
、 等]为原料合成亚铁氰化钾的工艺流程如下:
等]为原料合成亚铁氰化钾的工艺流程如下:
下列说法错误的是
A.“调” 时,选用的试剂X可以是 时,选用的试剂X可以是 |
B.“还原”后,可用溶液 检验 检验 是否完全被还原 是否完全被还原 |
C.“反应”时,发生的反应有: 和 和 |
D.“滤渣II”的主要成分是 , , 的溶解度比 的溶解度比 的大 的大 |
您最近一年使用:0次
5 . 为探完某固体化合物X(仅含有三种元素)的组成和性设计并完成如图实验:

已知:化合物A、气体甲、气体乙均为纯净物,气体体积均折合成标准状况。
请回答:
(1)化合物X含有的元素为_______ (写元素符号)。化合物A的化学式为_______ 。
(2)X隔绝空气加热分解为A的化学方程式为_______ 。
(3)如图装置将溶液B制取某药剂Y(白色固体,难溶于水):

装置丙中,先将导管移出液面通入一段时间气体,再向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量B溶液,产生白色沉淀,过滤、洗涤、干燥,得到Y固体。
①试剂a是_______ 。
②向Na2CO3溶液通入CO2的目的是_______ 。
③丙装置中制取Y的离子方程式为_______ 。
(4)不可用酸性高锰酸钾溶液检验溶液B中的金属阳离子的原因是_____

已知:化合物A、气体甲、气体乙均为纯净物,气体体积均折合成标准状况。
请回答:
(1)化合物X含有的元素为
(2)X隔绝空气加热分解为A的化学方程式为
(3)如图装置将溶液B制取某药剂Y(白色固体,难溶于水):

装置丙中,先将导管移出液面通入一段时间气体,再向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量B溶液,产生白色沉淀,过滤、洗涤、干燥,得到Y固体。
①试剂a是
②向Na2CO3溶液通入CO2的目的是
③丙装置中制取Y的离子方程式为
(4)不可用酸性高锰酸钾溶液检验溶液B中的金属阳离子的原因是
您最近一年使用:0次
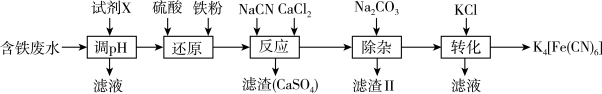
6 . 亚铁氰化钾K4[Fe(CN)6]是一种黄色颜料。以含铁废水[主要成分为Fe2(SO4)3,含少量NiSO4,CuSO4等]为原料合成亚铁氰化钾的工艺流程如下:
下列说法不正确 的是

下列说法
| A.“调pH”时选用的试剂X可以是钢和镍的氧化物 |
| B.“还原”后可用KSCN溶液检验Fe3+是否被完全还原 |
| C.“反应”时Fe2+提供孤电子对给予CN-形成配位键 |
| D.“滤液Ⅱ”的主要成分是CaCO3 |
您最近一年使用:0次
2022-12-16更新
|
470次组卷
|
3卷引用:江苏省如皋中学2022-2023学年高三上学期第二次阶段考试化学试题
7 . 硫氰化钾(KSCN)是常用的分析试剂,用硫磺与KCN等为原料制备KSCN的实验流程如图:
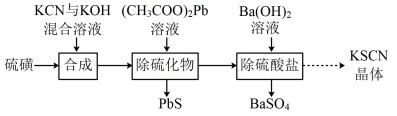
已知:①Ka(HSCN)=0.13,Ka(HCN)=6.2×10-10,Ksp(PbS)=9.0×10-29
②S+KCN KSCN(放热反应)
KSCN(放热反应)
(1)合成。将硫磺与一定量水配成悬浊液加入如图所示的反应釜中,在搅拌下滴入KCN与KOH混合溶液。
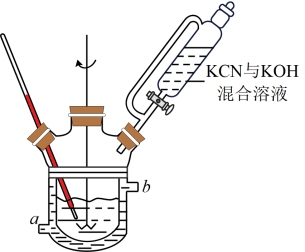
①冷水从____ (填“a”或“b”)端通入。
②若反应温度过高,可采取的措施有:减慢滴加KCN与KOH混合溶液的速率、____ 。
③反应釜中还有副反应发生,如硫磺与KOH溶液反应生成K2S和K2S2O3,该反应的化学方程式为_____ 。
(2)除硫化物。由于成品中不能含有铅,故加入(CH3COO)2Pb溶液只能略微不足。证明(CH3COO)2Pb溶液略微不足的实验操作与现象是____ 。
(3)除硫酸盐。选用Ba(OH)2溶液而不选用BaCl2溶液的原因是____ 。
(4)KSCN纯度测定。溶液pH介于0~1时,用KSCN溶液滴定已知浓度的AgNO3溶液来测定KSCN纯度,发生反应为SCN-+Ag+=AgSCN↓。请补充完整实验方案:①准确称取1.0000g样品,溶于适量蒸馏水,将溶液完全转移到100.00mL容量瓶中,定容得溶液A;②量取20.00mL____ ;③重复实验两次,计算消耗溶液A的平均体积为VmL;④通过公式w(KSCN)=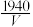 %计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。
%计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。

已知:①Ka(HSCN)=0.13,Ka(HCN)=6.2×10-10,Ksp(PbS)=9.0×10-29
②S+KCN
 KSCN(放热反应)
KSCN(放热反应)(1)合成。将硫磺与一定量水配成悬浊液加入如图所示的反应釜中,在搅拌下滴入KCN与KOH混合溶液。

①冷水从
②若反应温度过高,可采取的措施有:减慢滴加KCN与KOH混合溶液的速率、
③反应釜中还有副反应发生,如硫磺与KOH溶液反应生成K2S和K2S2O3,该反应的化学方程式为
(2)除硫化物。由于成品中不能含有铅,故加入(CH3COO)2Pb溶液只能略微不足。证明(CH3COO)2Pb溶液略微不足的实验操作与现象是
(3)除硫酸盐。选用Ba(OH)2溶液而不选用BaCl2溶液的原因是
(4)KSCN纯度测定。溶液pH介于0~1时,用KSCN溶液滴定已知浓度的AgNO3溶液来测定KSCN纯度,发生反应为SCN-+Ag+=AgSCN↓。请补充完整实验方案:①准确称取1.0000g样品,溶于适量蒸馏水,将溶液完全转移到100.00mL容量瓶中,定容得溶液A;②量取20.00mL
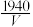 %计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。
%计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。
您最近一年使用:0次
解题方法
8 . 磷酸亚铁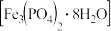 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产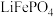 的原料,实验室利用
的原料,实验室利用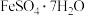 、
、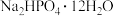 及
及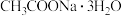 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:
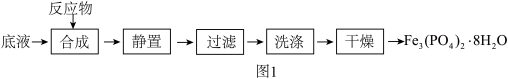
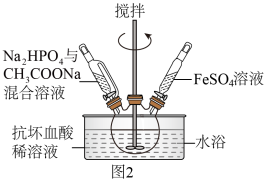
合成时的主要反应为: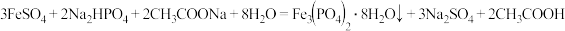
 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______ 。
 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入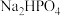 与
与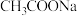 混合溶液至
混合溶液至 时,再滴入
时,再滴入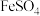 溶液,最终维持
溶液,最终维持 装置如图2所示
装置如图2所示 。
。
 实验不是将三种溶液直接混合的原因是
实验不是将三种溶液直接混合的原因是______ 。
 用抗坏血酸溶液作底液而不用铁粉,其主要原因是
用抗坏血酸溶液作底液而不用铁粉,其主要原因是______ 。
 生成的
生成的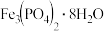 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是______
 检验产品中是否混有
检验产品中是否混有 或
或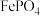 杂质的方法是
杂质的方法是______ 。
 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠 含
含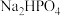 、重金属盐及有色杂质等
、重金属盐及有色杂质等 提纯得到
提纯得到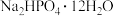 晶体。已知:
晶体。已知: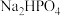 溶液pH
溶液pH  ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。
请补充实验步骤
 实验中必须使用的试剂有:
实验中必须使用的试剂有: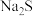 溶液、活性炭、
溶液、活性炭、 溶液、乙醇
溶液、乙醇 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度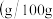 水
水
将工业品溶于适量热水,______ 。
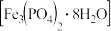 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产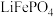 的原料,实验室利用
的原料,实验室利用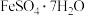 、
、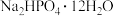 及
及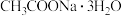 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:

合成时的主要反应为:
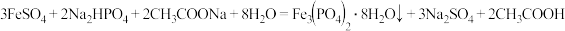
 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入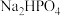 与
与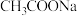 混合溶液至
混合溶液至 时,再滴入
时,再滴入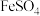 溶液,最终维持
溶液,最终维持 装置如图2所示
装置如图2所示 。
。 实验不是将三种溶液直接混合的原因是
实验不是将三种溶液直接混合的原因是 用抗坏血酸溶液作底液而不用铁粉,其主要原因是
用抗坏血酸溶液作底液而不用铁粉,其主要原因是 生成的
生成的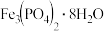 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是 检验产品中是否混有
检验产品中是否混有 或
或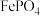 杂质的方法是
杂质的方法是 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠 含
含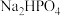 、重金属盐及有色杂质等
、重金属盐及有色杂质等 提纯得到
提纯得到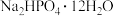 晶体。已知:
晶体。已知: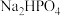 溶液pH
溶液pH  ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。请补充实验步骤
 实验中必须使用的试剂有:
实验中必须使用的试剂有: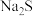 溶液、活性炭、
溶液、活性炭、 溶液、乙醇
溶液、乙醇 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度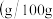 水
水
温度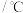 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
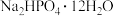 | 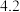 | 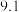 | 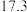 | 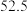 | |||||||
 | 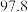 | ||||||||||
 |  | 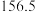 | 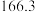 |  | 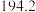 | ||||||
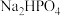 | 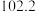 |
您最近一年使用:0次
名校
解题方法
9 . 铁是生产、生活及生命中的重要元素。
(1)血红蛋白中的铁元素呈+2价,具有结合O2分子结合成氧合血红蛋白的能力。如果误服亚硝酸盐,会使人中毒,因为二价铁被_______ (填“氧化”或“还原”)。
(2)为防止FeCl2发生氧化反应而变质,存放时应加入_____ (填化学式)。现有一瓶久置的FeCl2溶液,请设计实验检验其中是否含有Fe3+__________________________ 。
(3)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型消毒剂。在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:__________________________ ;高铁酸钠对水消毒时转化为Fe3+,Fe3+ 净水的有关离子方程式为___________________ 。
(4)球墨铸铁中含有一种铁碳化合物X。实验小组为测定X的组成设计实验如下:
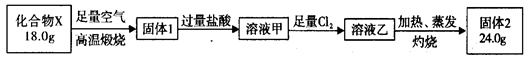
固体2的俗名是________ ,X的化学式可以表示为________ 。
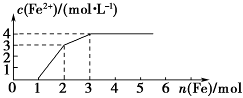
(5)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为________ 。
 。
。
(1)血红蛋白中的铁元素呈+2价,具有结合O2分子结合成氧合血红蛋白的能力。如果误服亚硝酸盐,会使人中毒,因为二价铁被
(2)为防止FeCl2发生氧化反应而变质,存放时应加入
(3)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型消毒剂。在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:
(4)球墨铸铁中含有一种铁碳化合物X。实验小组为测定X的组成设计实验如下:

固体2的俗名是
(5)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
 。
。
您最近一年使用:0次
2014·江苏南通·二模
名校
10 . 三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
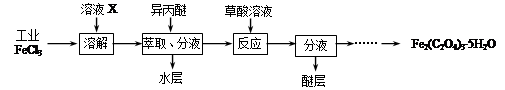
①为抑制FeCl3水解,溶液X为____________ 。
②上述流程中FeCl3能被异丙醚萃取,其原因是_________ ;检验萃取、分液后所得水层中是否含有Fe3+的方法是______________ 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是__________________ 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器________________ (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是________________ 。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;__________ ;___________ ;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O;________________ ,得到无水FeCl3。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

①为抑制FeCl3水解,溶液X为
②上述流程中FeCl3能被异丙醚萃取,其原因是
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;
您最近一年使用:0次
2016-12-09更新
|
721次组卷
|
4卷引用:2014届江苏省南通市高三第二次调研化学试卷
(已下线)2014届江苏省南通市高三第二次调研化学试卷2016届江苏省泰州中学高三上学期第二次质检化学试卷2017届江苏省南通市高三高考全真模拟(二)化学试卷福建省福州一中2019-2020学年高二下学期第一次月考化学试题



