10-11高三上·福建·期中
1 . Fe2O3和Cu2O都是红色粉末,常用作颜料。某校研究性学习小组通过实验探究一包红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸后生成Cu和CuSO4
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是_______________________ 。
(2)若滴加 KSCN 试剂后溶液无明显现象,则证明原固体粉末中一定不含Fe2O3。你认为这种说法合理吗?___________ 。(填“合理”或“不合理”)
(3)若固体粉末完全溶解即溶液中无固体存在, 滴加KSCN 试剂时溶液无明显现象, 则证明原固体粉末是_________________ ,写出相关反应的离子方程式:________________________________________________________________________ 。
查阅资料:Cu2O溶于稀硫酸后生成Cu和CuSO4
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液无明显现象,则证明原固体粉末中一定不含Fe2O3。你认为这种说法合理吗?
(3)若固体粉末完全溶解即溶液中无固体存在, 滴加KSCN 试剂时溶液无明显现象, 则证明原固体粉末是
您最近一年使用:0次
2010·海南·一模
2 . Fe2O3和Cu2O都是砖红色粉末,课外小组通过实验探究某砖红色粉末是Fe2O3、Cu2O或者是二者混合物。探究过程如下:
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末为Fe2O3、Cu2O的混合物
设计探究实验:
取少量粉末,向其加入足量稀盐酸在所得溶液中滴加苯酚溶液
(1)若假设1成立,则实验现象是__________ 。
(2)若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理______ (填“合理”或“不合理”),简述理由___________ 。
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是_____ ,相关的离子方程式为______________ 。(任写其中一个)
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末为Fe2O3、Cu2O的混合物
设计探究实验:
取少量粉末,向其加入足量稀盐酸在所得溶液中滴加苯酚溶液
(1)若假设1成立,则实验现象是
(2)若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是
您最近一年使用:0次
3 . 将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
| 操作 | 现象 | |
| ① | 加入NaOH溶液 | 有红褐色沉淀 |
| ② | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| ③ | 加入酸性KMnO4溶液 | 紫色褪去 |
| ④ | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A.②④ | B.④ | C.②③④ | D.①②③④ |
您最近一年使用:0次
名校
4 . 下列对物质或离子的检验,结论正确的是
| A.加入KSCN溶液,溶液变红,证明原溶液含有Fe3+ |
| B.将气体通入KMnO4酸性溶液,紫色褪色,证明气体为乙烯 |
| C.将气体通入澄清石灰水,有白色沉淀,证明气体为CO2 |
| D.加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42- |
您最近一年使用:0次
2016-12-09更新
|
153次组卷
|
3卷引用:2017届江西省高三上学期第一次联考化学试卷
解题方法
5 . 钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I、打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体;铁粉与水蒸气在高温下也可生成该黑色固体,
(1)反应的化学方程式为__________________________ 。
(2)将该黑色固体溶于盐酸中,反应的离子反应方程式_____________________ 。
II、某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
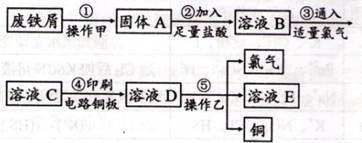
请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl 2+H 2↑外,其他可能反应的离子方程式为___________ 。
(2)若将③改加H2O2书写离子反应方程式_________ 。
(3)若溶液B中只含有Fe 2+而不含Fe 3+,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
(4)步骤④化学方程式为______________________ 。
(5)若除去氯化铜中氯化铁可以加入剂______________________ 。
I、打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体;铁粉与水蒸气在高温下也可生成该黑色固体,
(1)反应的化学方程式为
(2)将该黑色固体溶于盐酸中,反应的离子反应方程式
II、某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl 2+H 2↑外,其他可能反应的离子方程式为
(2)若将③改加H2O2书写离子反应方程式
(3)若溶液B中只含有Fe 2+而不含Fe 3+,可证明该事实的实验方法是
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
| A.①② | B.②③ | C.③④ | D.①④ |
(5)若除去氯化铜中氯化铁可以加入剂
您最近一年使用:0次
解题方法
6 . 电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某电子厂用过的腐蚀液中含有Fe3+、Cu2+,可以通过下列流程回收铜,并重新获得FeCl3溶液。
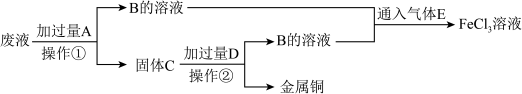
(1)检验溶液中含有Fe3+常用的试剂是________ ,证明Fe3+存在的现象是_________ ;
(2)操作①是______ ,C的成分是_________ ;
(3)废液中的Fe3+与A反应的离子方程式是____________ ,向B的溶液中滴加NaOH溶液时观察到的现象是______________ 。
(4)B与E反应的化学方程式是________________ 。

(1)检验溶液中含有Fe3+常用的试剂是
(2)操作①是
(3)废液中的Fe3+与A反应的离子方程式是
(4)B与E反应的化学方程式是
您最近一年使用:0次
7 . 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
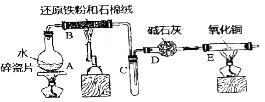
(1)装置B中发生反应的化学方程式是________ ;
(2)装置E中的现象是________ ;
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①欲检验溶液里含有Fe3+,选用的试剂为________ ,现象是________ ;
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因________ ;
③将此溶液中FeCl2完全氧化为FeCl3,最好选择下列物质中的________
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是________ 。

(1)装置B中发生反应的化学方程式是
(2)装置E中的现象是
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①欲检验溶液里含有Fe3+,选用的试剂为
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因
③将此溶液中FeCl2完全氧化为FeCl3,最好选择下列物质中的
| A.酸性KMnO4溶液 | B.Cl2 | C.Na2O2 | D.FeCl3 |
您最近一年使用:0次
2016-12-09更新
|
424次组卷
|
3卷引用:2015-2016学年山西省怀仁一中高一下第一次月考化学试卷
2015-2016学年山西省怀仁一中高一下第一次月考化学试卷(已下线)第三章 章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)安徽省池州市第一中学2020-2021学年高一12月月考化学试题
8 . 利用明矾石(主要成分:K2SO4·Al2(SO4)3·2Al2O3·6H2O,少量杂质Fe2O3)制备氢氧化铝的流程如下图所示:

(1)焙烧炉中反应为:2Al2(SO4)3+3S=2Al2O3+9SO2;该反应的氧化剂及被氧化的元素分别是:_________ ;若生成1 mol Al2O3,则转移电子数是______ 个;
(2)熟料溶解时的离子方程式:__________________________________ 。
(3)检验废渣中含有Fe2O3所需的试剂:________________ 。所观察到的现象为_________ 。
(4)母液中溶质的主要成分的化学式为:_____________ ;溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀洗涤干净的实验操作和现象是:_______________ 。

(1)焙烧炉中反应为:2Al2(SO4)3+3S=2Al2O3+9SO2;该反应的氧化剂及被氧化的元素分别是:
(2)熟料溶解时的离子方程式:
(3)检验废渣中含有Fe2O3所需的试剂:
(4)母液中溶质的主要成分的化学式为:
您最近一年使用:0次
解题方法
9 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是________ nm。
(3)电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式_____________________ 。某同学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少量待测溶液,滴入KSCN溶液呈红色,则溶液中所含金属阳离子有___________ 。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是___________ (用字母代号填)。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下:
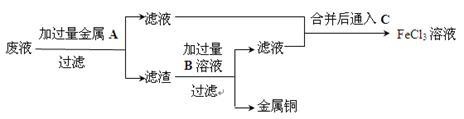
①写出上述实验中有关物质的化学式:A:_____________ ;B:_____________ 。
②写出通入C的化学方程式__________________________________ 。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
| A.Fe | B.FeCl3 | C.FeSO4 | D.Fe2O3 |
(3)电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下:

①写出上述实验中有关物质的化学式:A:
②写出通入C的化学方程式
您最近一年使用:0次
14-15高二上·山东德州·期中
名校
10 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是___ (用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是___ nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__ 。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是__ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05g。溶液中c(Cl-)=__ mol/L。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是__ 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
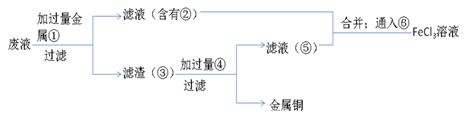
A.请写出上述实验中加入或生成的有关物质的化学式:
①___ ;②___ ;③___ ;④___ 。
B.请写出通入⑥的化学方程式___
(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:
①
B.请写出通入⑥的化学方程式
您最近一年使用:0次
2016-12-09更新
|
444次组卷
|
5卷引用:2014-2015学年山东省德州市普高高二上学期期中理科化学试卷
(已下线)2014-2015学年山东省德州市普高高二上学期期中理科化学试卷2014-2015甘肃省天水市一中高一上学期期末考试化学试卷2015-2016学年西藏日喀则高级中学高一上期末化学试卷新疆自治区北京大学附属中学新疆分校2019届高三上学期10月月考化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题



