1 . 将绿矾(FeSO4•7H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
【实验一】为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
【实验二】为进一步探究该反应的产物,进行了如下图所示的实验:
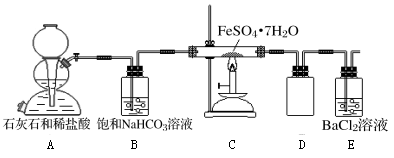
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________ 。
(2)饱和NaHCO3的作用是______ ,其水溶液呈碱性的原因(用离子方程式解释)____________ 。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________ 。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________ 。
【实验一】为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
| 猜想 | 实验操作 | 预期现象 |
| 猜想一:铁元素只显 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色 |
| 猜想二:铁元素只显 | 加入KSCN溶液呈 | |
| 猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
【实验二】为进一步探究该反应的产物,进行了如下图所示的实验:

(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是
(2)饱和NaHCO3的作用是
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为
(4)该组同学设计的装置存在着一个明显的缺陷是
您最近一年使用:0次
2016-12-09更新
|
370次组卷
|
2卷引用:2016届浙江省杭州高级中学高三上学期月考(三)化学试卷
2 . 铁、铝及其化合物在生活、生产中有着广泛的应用。
Ⅰ.某研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解进行研究。该小组同学称取a g硫酸亚铁晶体样品按下图图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。
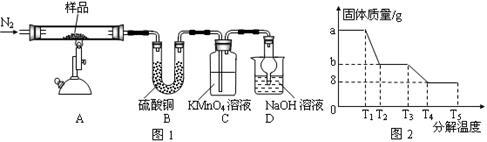
(1)装置B中硫酸铜粉末变蓝,质量增加12.6 g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有__________ 。
(2)实验中要持续通入氮气,否则测出的x会________ (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一种物质SO3,写出FeSO4分解的化学方程式______________________ 。
(5)某研究所利用SDTQ 600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系图如上图图2。根据两种热分解实验的有关数据,可计算出FeSO4•xH2O中的x=______________ 。
Ⅱ.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
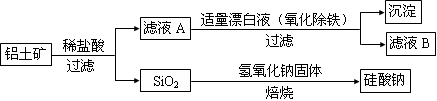
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的操作方法为:____________________ 。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___________ (填选项编号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:
边滴加浓盐酸边蒸发浓缩、___________ (填操作名称)、过滤、洗涤。
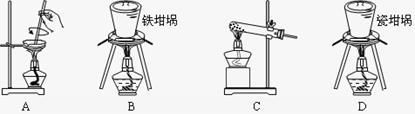
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___________ (填选项编号)。
Ⅰ.某研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解进行研究。该小组同学称取a g硫酸亚铁晶体样品按下图图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6 g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有
(2)实验中要持续通入氮气,否则测出的x会
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一种物质SO3,写出FeSO4分解的化学方程式
(5)某研究所利用SDTQ 600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系图如上图图2。根据两种热分解实验的有关数据,可计算出FeSO4•xH2O中的x=
Ⅱ.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的操作方法为:
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:
边滴加浓盐酸边蒸发浓缩、
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为

您最近一年使用:0次
名校
解题方法
3 . 部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共8.0 g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B.该样品中Cu、O元素的质量比为10:l |
| C.V=448 |
| D.溶解样品时消耗H2SO4的物质的量为0.04 mol |
您最近一年使用:0次
2016-11-28更新
|
1100次组卷
|
3卷引用:2017届山东省临沂市高三上学期期中化学试卷
12-13高三·广东佛山·阶段练习
4 . 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素_____________ ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验①_____________________ ;实验②____________________ 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是_________________ 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为__________________ 。(保留三位有效数字,相对原子质量:Fe:56 O:16)
【查阅资料】2KNO3
 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验①
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | |
| 步骤2:将产生的气体依次通过盛有足量 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为
您最近一年使用:0次
11-12高三上·山东泰安·期中
5 . (1)磁铁矿的主要成分是Fe3O4,其组成也可以表示成FeO·Fe2O3。现提供以下试剂,从中选择合适的药品,证明磁铁矿石中存在+2价铁元素。
试剂:稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KSCN溶液、KMnO4溶液、氯水
步骤及现象:
取少量磁铁矿石样品,加入过量的_______ 溶解,取溶解后的液体少许,加入__________ ,观察到__________________ 现象,可证明磁铁矿石中存在+2价铁元素。
(2)有Fe2+、NO-3、Fe3+、NO、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平)_____________________ 。
②该反应中氧化剂与还原剂的物质的量之比为__________________ 。
③产生2mol还原产物时转移电子的总数为_________________ 。
试剂:稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KSCN溶液、KMnO4溶液、氯水
步骤及现象:
取少量磁铁矿石样品,加入过量的
(2)有Fe2+、NO-3、Fe3+、NO、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平)
②该反应中氧化剂与还原剂的物质的量之比为
③产生2mol还原产物时转移电子的总数为
您最近一年使用:0次
13-14高三·浙江温州·开学考试
名校
6 . 部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.样品中CuO的质量为4.0 g |
| C.V=448 | D.原样品中Fe元素的质量分数为41% |
您最近一年使用:0次
2016-11-26更新
|
387次组卷
|
3卷引用:2015届浙江省“温州八校”高三返校联考化学试卷



