解题方法
1 . 下列实验操作、现象与结论相匹配的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向 溶液中加入 溶液中加入 溶液 溶液 | 有白色沉淀生成 |  结合 结合 的能力比 的能力比 弱 弱 |
| B | 将 溶液和 溶液和 溶液分别加入 溶液分别加入 溶液中 溶液中 | 均出现白色沉淀 |  溶液和 溶液和 溶液均可使 溶液均可使 的水解平衡正向移动 的水解平衡正向移动 |
| C | 常温下,将 苯与 苯与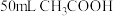 混合 混合 | 所得混合溶液的体积为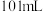 | 混合过程中削弱了 分子间的氢键,且苯与 分子间的氢键,且苯与 分子间的作用弱于氢键 分子间的作用弱于氢键 |
| D | 将 样品溶于稀 样品溶于稀 后,滴加 后,滴加 溶液 溶液 | 溶液显红色 |  晶体已氧化变质 晶体已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列“实验结论”与“实验操作及现象”一致的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品已变质 |
| B | 将HCI通入NaHCO3溶液,产生的气体通入Na2SiO3溶液中产生白色沉淀 | 酸性:H2CO3>H2SiO3 |
| C | 向KI—淀粉溶液中滴加氯水,溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 某溶液中加入BaCl2溶液,产生白色沉淀,再加入稀盐酸, 沉淀不消失 | 原溶液中一定存在SO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-07更新
|
192次组卷
|
2卷引用:贵州省思南中学2023-2024学年高三上学期第二次月考化学试题
3 . 下列实验设计可以达到实验目的的是
选项 | 实验目的 | 实验设计 |
A | 检验 | 将少量 |
B | 检验待测液中含有 | 用玻璃棒蘸取待测液在无色火焰上灼烧观察现象 |
C | 制备 | 将5~6滴饱和 |
D | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液和 | 比较HClO和 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 铁及其化合物之间的相互转化可用下式表示:Fe2+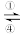 Fe3+
Fe3+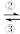 FeO42-(高铁酸根离子)。回答下列有关问题:
FeO42-(高铁酸根离子)。回答下列有关问题:
(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用__________ (填字母)。
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化学方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高铁酸钾)+3NaCl+2H2O,还原剂是______________ ,具有__________ 性。
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是___________ 、__________ 。
(4)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
②能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:________ 。
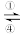 Fe3+
Fe3+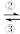 FeO42-(高铁酸根离子)。回答下列有关问题:
FeO42-(高铁酸根离子)。回答下列有关问题:(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化学方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高铁酸钾)+3NaCl+2H2O,还原剂是
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是
(4)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
| 实验现象 | 试管Ⅰ | 试管Ⅱ | 结论 |
| a | 褪色 | 不变红 | |
| b | 不褪色 | 变红 | |
| c | 褪色 | 变红 |
您最近一年使用:0次
5 . 化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
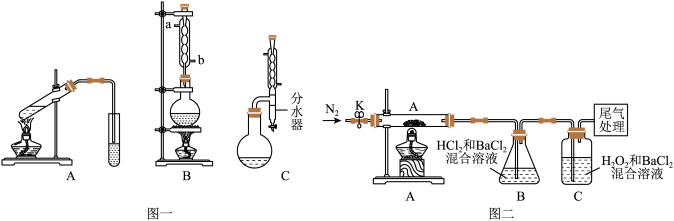
I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______ 口进入;乙同学认为图一中C装置效果更好,理由是_______ 。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________ 不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________ 溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______ (填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________ 。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________ 。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______ 。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______ 。(填序号)

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是
您最近一年使用:0次
2019-09-29更新
|
186次组卷
|
7卷引用:贵州省遵义正安县一中2020届高三上学期开学考试化学试题
6 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
430次组卷
|
7卷引用:贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题
贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐河南省南阳市六校2023-2024学年高一上学期12月月考化学试题
解题方法
7 . 电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。某项目学习小组设计如下流程处理废液和资源回收:
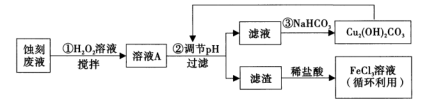
(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是___________ ;将FeCl3溶液蒸干、灼烧后,得到的主要固体产物是___________ 。
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有___________ (填离子符号)。
(3)步骤①中加入H2O2溶液的目的是___________ 。 (用离子方程式表示)。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是___________ 。
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式___________ 。
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为___________ (用字母表示,列出表达式即可)。

(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有
(3)步骤①中加入H2O2溶液的目的是
(4)已知:生成氢氧化物沉淀的pH
| Cu( OH)2 | Fe(OH)2 | Fe( OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为
您最近一年使用:0次
2021-02-27更新
|
601次组卷
|
6卷引用:贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题
贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题安徽省皖江名校联盟2021届高三下学期开年考(2月)理综化学试题(已下线)专题15 化学工艺流程-备战2021届高考化学二轮复习题型专练(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)广东省惠州市2022-2023学年高三上学期第二次调研考试 化学试题广东省惠州市2022-2023学年高三上学期第二次调研考试化学试题


 胶体
胶体 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止
溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 溶液的pH
溶液的pH

