1 . 根据所学知识填空
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:___________ 。
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
(3)向1mol KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀的物质的量最大时的离子方程式___________
(4)现有以下四种物质:
请根据题意选择恰当的选项用字母代号填空。
①可与KSCN溶液反应,溶液变红的是___________ ;
②常用于焙制糕点,也可用作抗酸药的是___________ ;
③可用于制备硅胶和木材防火剂的是___________ ;
④可用于制造计算机芯片的是___________ 。
(1)正长石的主要成分为KAlSi3O8,将其表示为氧化物形式:
(2)利用焰色反应可以定性鉴别某些金属盐。灼烧Li2SO4时,焰色为___________(填标号)。
| A.黄绿色 | B.洋红色 | C.紫红色 | D.绿色 |
(4)现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
①可与KSCN溶液反应,溶液变红的是
②常用于焙制糕点,也可用作抗酸药的是
③可用于制备硅胶和木材防火剂的是
④可用于制造计算机芯片的是
您最近一年使用:0次
解题方法
2 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。

请回答以下问题:
(1)K2FeO4中Fe的化合价为_____ 。
(2) 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与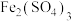 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为_____ ,当有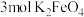 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为_____  。
。
(3)Fe2O3是否为碱性氧化物_____ (填是或否),理由:_____ 。
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:_____ ,其中检验溶液中Fe3+的试剂是KSCN溶液,该反应的离子方程式为:_____ 。

请回答以下问题:
(1)K2FeO4中Fe的化合价为
(2)
 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与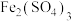 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为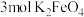 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为 。
。(3)Fe2O3是否为碱性氧化物
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:
您最近一年使用:0次
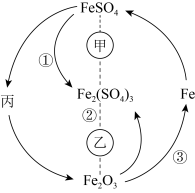
3 . 在一定条件下,某些物质具有如图所示的转化关系。丙为白色固体,其悬浊液在空气中会迅速变为灰绿色,最终变为红褐色。请回答下列问题: 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
(1)根据分析可知丙为______ (填化学式);甲可能是______ (填标号,下同),乙可能是______ 。
A.稀硝酸 B. 溶液
溶液
C. D.
D. 溶液
溶液
(2)实验室保存 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量______ (填药品名称);可以用______ (填化学式)溶液来检验 溶液中的
溶液中的 是否被氧化。
是否被氧化。
(3)丙的悬浊液在空气中变色的原因为______ (填化学方程式);工业上高炉炼铁可以实现③的转化,所得到的炽热的铁水注入模具之前,模具必须进行充分的干燥处理,原因是______ (填化学方程式)。
(4)绿矾 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为______ ;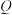 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为______ 。
 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。(1)根据分析可知丙为
A.稀硝酸 B.
 溶液
溶液C.
 D.
D. 溶液
溶液(2)实验室保存
 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量 溶液中的
溶液中的 是否被氧化。
是否被氧化。(3)丙的悬浊液在空气中变色的原因为
(4)绿矾
 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为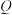 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为
您最近一年使用:0次
2024-03-27更新
|
169次组卷
|
5卷引用:江西省部分地区2023-2024学年高一下学期3月月考化学试题
名校
解题方法
4 . 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________ 。
(2)FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______ ;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________________________ ;
(1)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为
(2)FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
您最近一年使用:0次
5 . 某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol•L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___ 。
(2)甲同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____ 。
(3)乙同学取少量待测溶液(可能含有FeCl2、FeCl3)于试管中,滴加酸性高锰酸钾溶液,振荡后溶液紫色消失,乙同学由此得出结论:该待测溶液一定含有Fe2+。此结论不够严谨,理由是____ (结合离子方程式解释)。
(4)丙同学取10mL0.1mol•L-1KI溶液加入6mL0.1mol•L-1FeCl3溶液混合。取2mL此溶液于试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;写出发生反应的离子方程式_______________ 。
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液溶液变成棕黄色,发生反应的离子方程式为_______ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol•L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙同学取少量待测溶液(可能含有FeCl2、FeCl3)于试管中,滴加酸性高锰酸钾溶液,振荡后溶液紫色消失,乙同学由此得出结论:该待测溶液一定含有Fe2+。此结论不够严谨,理由是
(4)丙同学取10mL0.1mol•L-1KI溶液加入6mL0.1mol•L-1FeCl3溶液混合。取2mL此溶液于试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;写出发生反应的离子方程式
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
解题方法
6 . Fe3O4呈黑色,有磁性,应用广泛。以Fe3O4为吸附剂去除水中含磷物质是一种新的除磷措施。
(1)检验Fe3O4中铁元素的价态;用盐酸溶解Fe3O4,取少量滴加______________ ,溶液变红;另取少量滴加铁氰化钾溶液,产生蓝色沉淀。
(2)氧化沉淀法制备
I.向稀硫酸中加入过量铁粉,得到FeSO4溶液。加过量铁粉的作用是_________________ 。II.在氮气保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。将NaNO3溶液滴入Fe(OH)2浊液中,充分反应得到Fe3O4。
①用红色石蕊试纸检验产物,__________________ (填现象),证明有NH3。
②写出NaNO3溶液与Fe(OH)2反应制备Fe3O4的离子方程式___________________________ 。
(3)含磷各微粒在溶液中的物质的量分数与pH的关系如图所示:(图中三个交点的对应pH分别为2.2、7.2、12.4)。 下列分析不正确的是________________
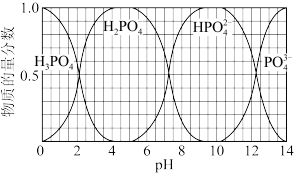
A.KH2PO4水溶液中:c(H+)< c(OH-)
B. K2HPO4溶液显碱性,原因是HPO42-的水解程度大于其电离程度
C.磷酸一级电离常数K1=10-2.2
D.想获得较纯的KH2PO4溶液,可将溶液pH控制 在4-5之间
(4)已知:信息①溶液pH对吸附剂Fe3O4表面所带电荷的影响:
pH <6.8,Fe3O4表面带正电荷;
pH=6.8,Fe3O4表面不带电荷;
pH >6.8,Fe3O4表面带负电荷。
信息②吸附剂Fe3O4对含磷微粒的去除率随pH的变化如图所示。现将吸附剂Fe3O4加到KH2PO4溶液中,调节溶液pH。请根据以上信息及图示回答下列问题:
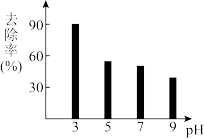
①pH=3时,吸附的主要微粒是__________________ 。
②与pH=5相比,pH=9时的去除率明显下降,原因是_____________________________ 。
(1)检验Fe3O4中铁元素的价态;用盐酸溶解Fe3O4,取少量滴加
(2)氧化沉淀法制备
I.向稀硫酸中加入过量铁粉,得到FeSO4溶液。加过量铁粉的作用是
①用红色石蕊试纸检验产物,
②写出NaNO3溶液与Fe(OH)2反应制备Fe3O4的离子方程式
(3)含磷各微粒在溶液中的物质的量分数与pH的关系如图所示:(图中三个交点的对应pH分别为2.2、7.2、12.4)。 下列分析不正确的是

A.KH2PO4水溶液中:c(H+)< c(OH-)
B. K2HPO4溶液显碱性,原因是HPO42-的水解程度大于其电离程度
C.磷酸一级电离常数K1=10-2.2
D.想获得较纯的KH2PO4溶液,可将溶液pH控制 在4-5之间
(4)已知:信息①溶液pH对吸附剂Fe3O4表面所带电荷的影响:
pH <6.8,Fe3O4表面带正电荷;
pH=6.8,Fe3O4表面不带电荷;
pH >6.8,Fe3O4表面带负电荷。
信息②吸附剂Fe3O4对含磷微粒的去除率随pH的变化如图所示。现将吸附剂Fe3O4加到KH2PO4溶液中,调节溶液pH。请根据以上信息及图示回答下列问题:

①pH=3时,吸附的主要微粒是
②与pH=5相比,pH=9时的去除率明显下降,原因是
您最近一年使用:0次
名校
解题方法
7 . 从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________ (用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为______________________ ,请用化学用语解释出现此现象的原因___________________ ;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____ Fe2+____ NO3-+____ H+ = ___ Fe3++____ NO↑+_____ H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________ 。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________ L。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是
(2)向FeSO4溶液中滴加氨水的现象为
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)
您最近一年使用:0次
2020-01-08更新
|
185次组卷
|
2卷引用:江西省赣县第三中学2020-2021学年高一上学期12月月考化学试题
名校
解题方法
8 . 久置的FeSO4溶液变黄,一般认为是Fe2+被氧化的缘故。回答下列问题:
(1)久置的FeSO4溶液中Fe3+的检验:向久置的FeSO4溶液中加入KSCN的现象为:______________________________
(2)除去久置FeSO4溶液中Fe3+:在溶液中加入足量铁粉,可以观察到的现象为:______________________ ;反应的离子方程式为:____________________________
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。写出Fe(OH)2在空气中被氧化的现象为_________________________ 写出化学方程式,并用双线桥标注电子转移:________________________________
(1)久置的FeSO4溶液中Fe3+的检验:向久置的FeSO4溶液中加入KSCN的现象为:
(2)除去久置FeSO4溶液中Fe3+:在溶液中加入足量铁粉,可以观察到的现象为:
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。写出Fe(OH)2在空气中被氧化的现象为
您最近一年使用:0次
解题方法
9 . 铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
Ⅰ.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______ nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________ 。检验反应后溶液中还存在Fe3+的试剂是__________ 。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______ 。
Ⅱ.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(4)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______ ,加铁粉后溶液增重的是 _____________ (填写离子符号)
(5)向Fe2+的溶液中滴加NaOH溶液,现象是___________________ 。
(6)欲除去FeCl2中FeCl3选用的试剂是________ ,并写出相应离子方程式:__________ 。
Ⅰ.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是
Ⅱ.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(4)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是
(5)向Fe2+的溶液中滴加NaOH溶液,现象是
(6)欲除去FeCl2中FeCl3选用的试剂是
您最近一年使用:0次
2018-01-31更新
|
212次组卷
|
2卷引用:江西省临川实验学校2017-2018学年高一上学期期末质量检测化学试题
名校
解题方法
10 . 铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是__ nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________ 。检验反应后溶液中还存在Fe3+的试剂是__________ 。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______ ,生成1molNa2FeO4转移电子数目为__________ 。
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是___ ,加铁粉后溶液增重的是__ ;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是______________________________________ 。
(3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法____________ ,并写出相应离子方程式:__________________ 。

I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是
(2)向Fe2+的溶液中滴加NaOH溶液,现象是
(3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法
您最近一年使用:0次
2017-03-06更新
|
663次组卷
|
3卷引用:2016-2017学年江西省南昌市第十中学高一上学期期末考试化学试卷



