解题方法
1 . 综合利用粉煤灰既有利于环境保护,又有利于资源节约。某种粉煤灰(主要含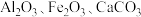 )的铝、铁分离工艺流程如下:
)的铝、铁分离工艺流程如下: 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
②提高浸出率的措施有_______ (写出一点即可)。
③当硫酸浓度大于 时,铝、铁的浸出率下降,可能的原因是
时,铝、铁的浸出率下降,可能的原因是_______ 。
(2)已知:部分氢氧化物开始沉淀和沉淀完全的 如下表所示。
如下表所示。
①“分离”过程中加入氨水调“浸出液” 的范围是
的范围是 ,其目的是
,其目的是_______ 。
②“浸出液”中加铁粉的作用是_______ 。
(3)燃煤烟气中 的捕集可通过如图所示的物质转化实现。
的捕集可通过如图所示的物质转化实现。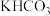 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为_______ ,载人航天器内,常用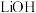 固体而很少用
固体而很少用 固体吸收空气中的
固体吸收空气中的 ,其原因是
,其原因是_______ 。
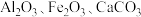 )的铝、铁分离工艺流程如下:
)的铝、铁分离工艺流程如下: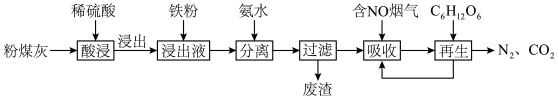
 发生反应的离子方程式为
发生反应的离子方程式为②提高浸出率的措施有
③当硫酸浓度大于
 时,铝、铁的浸出率下降,可能的原因是
时,铝、铁的浸出率下降,可能的原因是(2)已知:部分氢氧化物开始沉淀和沉淀完全的
 如下表所示。
如下表所示。| 氢氧化物 |  |  |  |
| 开始沉淀的pH | 1.5 | 3.2 | 7.1 |
| 沉淀完全的pH | 3.1 | 4.9 | 8.9 |
 的范围是
的范围是 ,其目的是
,其目的是②“浸出液”中加铁粉的作用是
(3)燃煤烟气中
 的捕集可通过如图所示的物质转化实现。
的捕集可通过如图所示的物质转化实现。
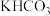 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为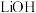 固体而很少用
固体而很少用 固体吸收空气中的
固体吸收空气中的 ,其原因是
,其原因是
您最近一年使用:0次
名校
解题方法
2 . 工业上以高硫铝土矿(主要成分为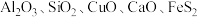 及其它不溶性物质)为原料,冶炼铝和铜并制得绿矾
及其它不溶性物质)为原料,冶炼铝和铜并制得绿矾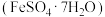 的工艺流程如图:
的工艺流程如图:______ 。
(2)焙烧Ⅱ过程中产生的污染性气体是______ (填化学式),大量排放该气体造成的主要环境问题是______ 。
(3)滤渣A中除其它不溶性物质外还有:______ 。
(4)反应②的离子方程式为:______ 。
(5)操作 包括
包括______ 、过滤、洗涤、干燥等操作。
(6)向溶液A中少量多次加入还原性铁粉,当看到______ 现象时停止加入铁粉,原因是______ 。
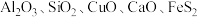 及其它不溶性物质)为原料,冶炼铝和铜并制得绿矾
及其它不溶性物质)为原料,冶炼铝和铜并制得绿矾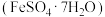 的工艺流程如图:
的工艺流程如图: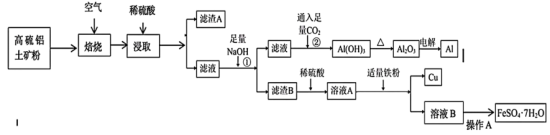
(2)焙烧Ⅱ过程中产生的污染性气体是
(3)滤渣A中除其它不溶性物质外还有:
(4)反应②的离子方程式为:
(5)操作
 包括
包括(6)向溶液A中少量多次加入还原性铁粉,当看到
您最近一年使用:0次
名校
解题方法
3 . 工业废水处理是我国环保产业的重要分支。一种处理钢厂酸洗废水(含Fe3+、Fe2+、Al3+等)的工艺流程如下图所示:
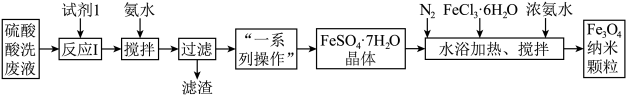
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)反应I的离子方程式为___________ 。
(2)加入少量氨水的目的是调节pH,操作时需控制pH值的范围为___________ 。
(3)通入N2的目的是___________ 。
(4)制备Fe3O4纳米颗粒的离子方程式为___________ 。
(5)如何检验硫酸酸洗废液中是否含有Fe2+?___________
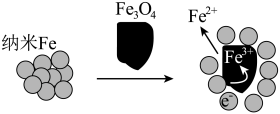
(6)纳米Fe和Fe3O4均可将Cr(Ⅵ)还原为Cr(Ⅲ)从而降解含Cr2O 的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O
的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O 的效果更佳,结合下图,分析其原因:
的效果更佳,结合下图,分析其原因:___________ 。
(7)将酸洗废液进行如下实验,检测废液中铁元素含量是否符合国家排放标准。
实验步骤:取100 ml酸洗废液,向其中滴加过量H2O2,微热;用淀粉作指示剂,滴加足量碘化钾至溶液变蓝;最后滴加 0.002 mol/L的硫代硫酸钠溶液至无色,消耗硫代硫酸钠溶液体积为12.7 ml。
已知:I2+2S2O =S4O
=S4O +2I-。废液中铁元素的物质的量浓度为
+2I-。废液中铁元素的物质的量浓度为 ___________ (保留至小数点后两位)。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I的离子方程式为
(2)加入少量氨水的目的是调节pH,操作时需控制pH值的范围为
(3)通入N2的目的是
(4)制备Fe3O4纳米颗粒的离子方程式为
(5)如何检验硫酸酸洗废液中是否含有Fe2+?
(6)纳米Fe和Fe3O4均可将Cr(Ⅵ)还原为Cr(Ⅲ)从而降解含Cr2O
 的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O
的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O 的效果更佳,结合下图,分析其原因:
的效果更佳,结合下图,分析其原因:
(7)将酸洗废液进行如下实验,检测废液中铁元素含量是否符合国家排放标准。
实验步骤:取100 ml酸洗废液,向其中滴加过量H2O2,微热;用淀粉作指示剂,滴加足量碘化钾至溶液变蓝;最后滴加 0.002 mol/L的硫代硫酸钠溶液至无色,消耗硫代硫酸钠溶液体积为12.7 ml。
已知:I2+2S2O
 =S4O
=S4O +2I-。废液中铁元素的物质的量浓度为
+2I-。废液中铁元素的物质的量浓度为
您最近一年使用:0次
4 . 研究性学习小组对 及其化合物的相关性质进行探究。
及其化合物的相关性质进行探究。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。
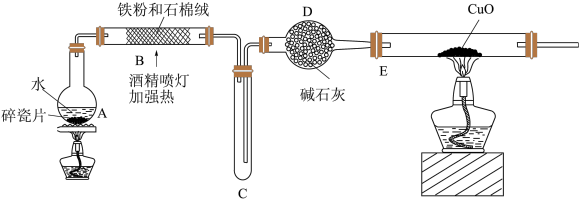
(1)A中放碎瓷片的目的是_______ 。
(2)硬质玻璃管b中发生反应的化学方程式为:_______ 。
(3)装置D的作用是_______ 。
探究二:确定探究一反应后硬质玻璃管B中黑色固体的成分。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,进行如下实验,请将下表补充完整:
探究三:利用如下图所示装置制备 。
。
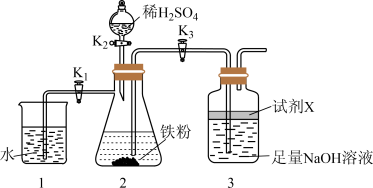
(5)试剂X可选用植物油,其主要作用是_______ 。
(6)实验开始时,打开分液漏斗塞子,关闭 ,依次打开
,依次打开 、
、 的目的是
的目的是_______ 。一段时间后关闭 ,打开
,打开 ,可观察到的现象是
,可观察到的现象是_______ 。
 及其化合物的相关性质进行探究。
及其化合物的相关性质进行探究。探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)A中放碎瓷片的目的是
(2)硬质玻璃管b中发生反应的化学方程式为:
(3)装置D的作用是
探究二:确定探究一反应后硬质玻璃管B中黑色固体的成分。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,进行如下实验,请将下表补充完整:
| 步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
I.取少量滤液,滴加 溶液 溶液 | 溶液不变红,为浅绿色 | 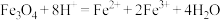 ① | 滤液中的阳离子为③ |
Ⅱ.取少量滤液,滴加 溶液 溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ② (白色); (白色);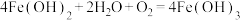 |
探究三:利用如下图所示装置制备
 。
。
(5)试剂X可选用植物油,其主要作用是
(6)实验开始时,打开分液漏斗塞子,关闭
 ,依次打开
,依次打开 、
、 的目的是
的目的是 ,打开
,打开 ,可观察到的现象是
,可观察到的现象是
您最近一年使用:0次
名校
解题方法
5 . 工业上用赤铁矿(主要含Fe2O3、FeO,还含有少量的Al2O3、CuO等杂质 制备绿矾(FeSO4∙7H2O)的流程如下:
制备绿矾(FeSO4∙7H2O)的流程如下:
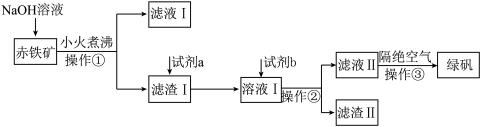
(1)NaOH溶液加入赤铁矿中发生反应的离子方程式为___________ 。
(2)滤液I通过一系列操作可得到Al2O3,该过程涉及化学反应的流程可表示为___________ 。(示例:滤液I B……)。
B……)。
(3)试剂a为___________ (填化学式),试剂 为
为___________ (填化学式),“溶液I”中氧化性最强的阳离子为___________ (填化学式)。
(4)操作③需要隔绝空气的主要原因是___________ 。
(5)8.34gFeSO4∙7H2O(M=278g∙mol-1)样品受热分解过程中样品质量随温度变化的曲线如图所示:
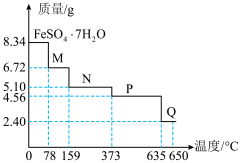
请回答下列问题
①温度为78℃时,固体物质M的化学式为___________ 。
②取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种常见含硫氧化物生成,则Q的化学式为___________ 。
 制备绿矾(FeSO4∙7H2O)的流程如下:
制备绿矾(FeSO4∙7H2O)的流程如下:
(1)NaOH溶液加入赤铁矿中发生反应的离子方程式为
(2)滤液I通过一系列操作可得到Al2O3,该过程涉及化学反应的流程可表示为
 B……)。
B……)。(3)试剂a为
 为
为(4)操作③需要隔绝空气的主要原因是
(5)8.34gFeSO4∙7H2O(M=278g∙mol-1)样品受热分解过程中样品质量随温度变化的曲线如图所示:

请回答下列问题
①温度为78℃时,固体物质M的化学式为
②取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种常见含硫氧化物生成,则Q的化学式为
您最近一年使用:0次
6 . 铁、铜等金属及其化合物在日常生产生活中有非常广泛的用途。
I.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子: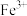 、
、 ,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。

(1)操作①的名称是___________ 。加入铁屑先发生的离子反应为:___________ 。
(2)沉淀A中含有的金属单质有___________ 。
(3)操作②中观察到的实验现象是___________ 。
(4)操作③中发生反应的离子方程式为___________ 。
II.某化学实验小组通过实验来探究一包黑色粉是否含有 、CuO,探究过程如下:
、CuO,探究过程如下:
提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是 ;
;
假设3.黑色粉末是CuO和 的混合物。
的混合物。
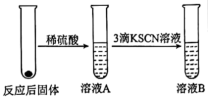
设计探究实验:取少量粉末放入足量稀硫酸中,得溶液X,取一定量X于试管中,向其中滴加KSCN溶液。
(5)若假设1成立,则实验现象是___________ 。
(6)若假设2成立,则实验现象是___________ 。如何检验溶液X中含 离子?
离子?___________ 。
(7)若假设3成立,需继续向X溶液加入足量铁粉,则实验现象是___________ 。
I.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:
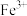 、
、 ,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
(1)操作①的名称是
(2)沉淀A中含有的金属单质有
(3)操作②中观察到的实验现象是
(4)操作③中发生反应的离子方程式为
II.某化学实验小组通过实验来探究一包黑色粉是否含有
 、CuO,探究过程如下:
、CuO,探究过程如下:提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是
 ;
;假设3.黑色粉末是CuO和
 的混合物。
的混合物。设计探究实验:取少量粉末放入足量稀硫酸中,得溶液X,取一定量X于试管中,向其中滴加KSCN溶液。
(5)若假设1成立,则实验现象是
(6)若假设2成立,则实验现象是
 离子?
离子?(7)若假设3成立,需继续向X溶液加入足量铁粉,则实验现象是
您最近一年使用:0次
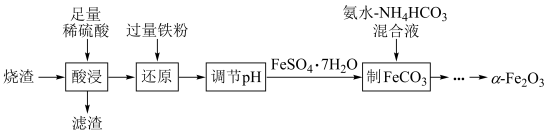
7 . 实验室由硫铁矿烧渣(主要成分为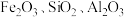 )制备软磁性材料
)制备软磁性材料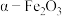 ,主要转化流程如下。
,主要转化流程如下。
已知: 为酸性氧化物。
为酸性氧化物。
回答下列问题:
(1)“酸浸”时, 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为______________ ;“滤渣”中主要成分的化学式为______________ 。
(2)“还原”时,加入过量铁粉的主要目的是______________ ;该过程除生成 外,还会生成
外,还会生成_______ (填化学式)。
(3)根据表格信息,“调节 ”时的
”时的 范围为
范围为_______ 。
(4)“调节 ”后获得
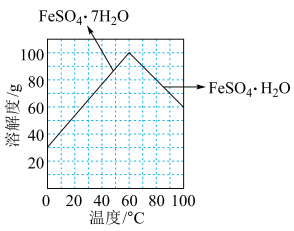
”后获得 晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节
晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节 ”后获得
”后获得 晶体的实验操作:向
晶体的实验操作:向 溶液中先加入稀硫酸酸化,在
溶液中先加入稀硫酸酸化,在 氛围中,
氛围中,_______ ,过滤,少量冰水洗涤,低温干燥,得到 晶体。
晶体。
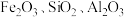 )制备软磁性材料
)制备软磁性材料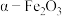 ,主要转化流程如下。
,主要转化流程如下。
离子 | 开始沉淀 | 完全沉淀 |
| 5.8 | 8.8 |
| 1.6 | 2.8 |
| 3.2 | 5.0 |
 为酸性氧化物。
为酸性氧化物。回答下列问题:
(1)“酸浸”时,
 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为(2)“还原”时,加入过量铁粉的主要目的是
 外,还会生成
外,还会生成(3)根据表格信息,“调节
 ”时的
”时的 范围为
范围为(4)“调节
 ”后获得
”后获得 晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节
晶体,根据如图所示的绿矾溶解度曲线,补充完整“调节 ”后获得
”后获得 晶体的实验操作:向
晶体的实验操作:向 溶液中先加入稀硫酸酸化,在
溶液中先加入稀硫酸酸化,在 氛围中,
氛围中, 晶体。
晶体。
您最近一年使用:0次
名校
8 . 高铁酸钠( )是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量
)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量 )制取
)制取 并回收金属Cu,工艺流程如下:
并回收金属Cu,工艺流程如下:
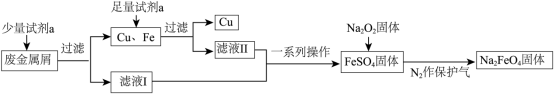
(1)试剂a为___________ (填化学式)。
(2)用离子方程式解释滤液I不含有 可能的原因
可能的原因___________ 。
(3)制备 的原理:
的原理: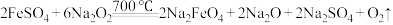 。反应中
。反应中___________ 作还原剂;每生成1mol 转移电子的物质的量为
转移电子的物质的量为___________ mol。
(4)高铁酸钠( )是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
①某兴趣小组欲用 固体配制100mL
固体配制100mL 的高铁酸钠溶液,需要高铁酸钠固体的质量为
的高铁酸钠溶液,需要高铁酸钠固体的质量为___________ g。配制所用的容量瓶上标有___________ 、___________ 、刻度线。
②下列操作导致浓度偏低的是___________ 。
A.容量瓶用蒸馏水洗净之后,直接用于溶液的配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
D.定容时,俯视刻度线
 )是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量
)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量 )制取
)制取 并回收金属Cu,工艺流程如下:
并回收金属Cu,工艺流程如下:
(1)试剂a为
(2)用离子方程式解释滤液I不含有
 可能的原因
可能的原因(3)制备
 的原理:
的原理: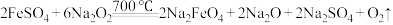 。反应中
。反应中 转移电子的物质的量为
转移电子的物质的量为(4)高铁酸钠(
 )是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。①某兴趣小组欲用
 固体配制100mL
固体配制100mL 的高铁酸钠溶液,需要高铁酸钠固体的质量为
的高铁酸钠溶液,需要高铁酸钠固体的质量为②下列操作导致浓度偏低的是
A.容量瓶用蒸馏水洗净之后,直接用于溶液的配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
D.定容时,俯视刻度线
您最近一年使用:0次
名校
解题方法
9 . 铁是人类较早使用的金属之一,运用所学知识,回答下列问题。
I.某学习小组研究 腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
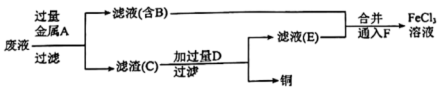
(1)滤渣C中所含物质的化学式为___________ ;通入F发生反应的离子方程式为___________ 。
(2)滤渣C与试剂D反应的离子方程式为_______ ,为测定滤渣中铜的质量分数,取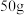 的滤渣与足量的试剂D反应,得到
的滤渣与足量的试剂D反应,得到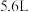 气体(标准状况下),试计算滤渣中铜的质量分数
气体(标准状况下),试计算滤渣中铜的质量分数______ 。
Ⅱ.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验
请回答:
(3)实验I中反应的化学方程式是___________ 。
(4)甲同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色,则溶液B未呈现红色的原因是___________ 。(写出反应的离子方程式)
(5)实验室在制备 时必须隔绝空气,否则发生的现象是
时必须隔绝空气,否则发生的现象是___________ ;反应化学方程式为___________ 。
I.某学习小组研究
 腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
(1)滤渣C中所含物质的化学式为
(2)滤渣C与试剂D反应的离子方程式为
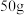 的滤渣与足量的试剂D反应,得到
的滤渣与足量的试剂D反应,得到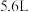 气体(标准状况下),试计算滤渣中铜的质量分数
气体(标准状况下),试计算滤渣中铜的质量分数Ⅱ.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验
| 实验I | 实验Ⅱ |
 |  |
(3)实验I中反应的化学方程式是
(4)甲同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色,则溶液B未呈现红色的原因是
(5)实验室在制备
 时必须隔绝空气,否则发生的现象是
时必须隔绝空气,否则发生的现象是
您最近一年使用:0次
名校
10 . 绿矾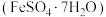 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为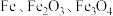 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:
(1)“焙烧”的目的是______ 。
(2)提高“酸溶”反应速率的措施是______ (任写一条)。“反应”时发生反应的离子方程式为______ 。
(3)隔绝空气的目的是______ ;一系列操作包括______ 、干燥。
(4)“酸溶”后,若溶液中 为
为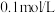 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于______  已知:
已知: 。
。
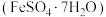 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为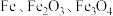 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下: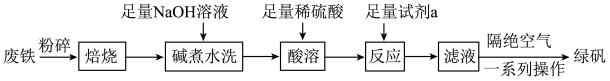
(1)“焙烧”的目的是
(2)提高“酸溶”反应速率的措施是
(3)隔绝空气的目的是
(4)“酸溶”后,若溶液中
 为
为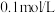 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于 已知:
已知: 。
。
您最近一年使用:0次




