名校
解题方法
1 . 锗是一种稀散金属,在光纤通信、航空航天等领域有广泛应用,模拟从氧化锌烟灰(成分有ZnO、ZnO·GeO2、FeO·GeO2、Fe2O3·GeO2、PbO等)中提取锗元素的流程图如下:
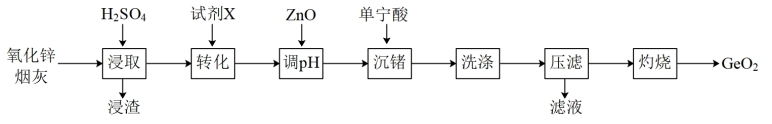
已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。
(1)浸取时ZnO·GeO2发生反应的化学方程式是_______ ,浸渣的主要成分是_______ 。
(2)试剂X的作用是_______ 。
(3)下图为沉锗时溶液pH对锗沉淀率的影响,则适宜的pH应为_______(填标号)。

(4)沉锗时有一段沉锗和二段沉锗两种工艺,单宁酸用量与锗沉淀率关系如表所示,工业常用二段沉锗工艺且单宁酸总用量为25倍,其原因是_______ 。
(5)可从滤液中回收的金属元素主要有_______ 。
(6)若用C2H2O表示单宁酸,压滤后的含锗沉淀表示为GeO(C2H2O)2SO4,其在空气中灼烧会得到SO2、H2O、CO2三种气体,该反应方程式为_______ 。

已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。
(1)浸取时ZnO·GeO2发生反应的化学方程式是
(2)试剂X的作用是
(3)下图为沉锗时溶液pH对锗沉淀率的影响,则适宜的pH应为_______(填标号)。

| A.1.0 | B.2.0 | C.2.5 | D.3.0 |
| 一段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
| 锗沉淀率/% | 88.5 | 89.5 | 90.5 | 91.5 | 93.5 |
| 二段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
| 锗沉淀率/% | 92 | 93.5 | 94.5 | 97 | 97.5 |
(6)若用C2H2O表示单宁酸,压滤后的含锗沉淀表示为GeO(C2H2O)2SO4,其在空气中灼烧会得到SO2、H2O、CO2三种气体,该反应方程式为
您最近一年使用:0次
2022-05-19更新
|
1717次组卷
|
7卷引用:安徽省淮南市2022届高三第二次模拟考试理科综合化学试题
安徽省淮南市2022届高三第二次模拟考试理科综合化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)T26-工业流程题辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题
解题方法
2 . 某同学实验室研究 时,进行了以下实验,回答有关问题。
时,进行了以下实验,回答有关问题。
(1)配制 溶液
溶液
称取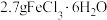 晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
①配制的溶液不显黄色而显红褐色,原因是___________ ;若要获得黄色 溶液,改进配制方法是
溶液,改进配制方法是___________ 。
②配制溶液时没有使用容量瓶,所得溶液___________ (填“能”或“不能”)满足本实验要求。
(2)探究
“实验I”振荡后的现象是___________ ;用离子方程式解释该现象___________ 。
(3)探究实验II中白色沉淀的成分
查阅资料:CuCl、CuSCN均为白色难溶物, ,
, ,
, 与卤素离子性质相似。
与卤素离子性质相似。
为了进一步确定白色沉淀的成分,补充如下实验:
在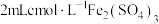 溶液中,加入3滴
溶液中,加入3滴 溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
①c=_______ ,依据该实验可知白色沉淀一定含有_________ 。
②该实验中产生白色沉淀的反应分两步,请写出第二步反应的离子方程式。
i.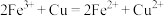 ;
;
ii.___________ 。
③依据以上实验,仍无法确定白色沉淀的组成;还需要将“补充实验”所得混合物进一步实验,即可得出结论。简述操作步骤:_____ 。
 时,进行了以下实验,回答有关问题。
时,进行了以下实验,回答有关问题。(1)配制
 溶液
溶液称取
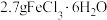 晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。①配制的溶液不显黄色而显红褐色,原因是
 溶液,改进配制方法是
溶液,改进配制方法是②配制溶液时没有使用容量瓶,所得溶液
(2)探究

| 序号 | 实验步骤 | 实验现象 |
| I | 在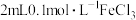 溶液中,加入3滴 溶液中,加入3滴 溶液,再加入足量铁粉,振荡。 溶液,再加入足量铁粉,振荡。 | 溶液变为血红色,振荡后… |
| II | 在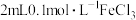 溶液中,加入3滴 溶液中,加入3滴 溶液,再加入足量铜粉,振荡。 溶液,再加入足量铜粉,振荡。 | 溶液变为血红色,振荡后红色褪去,产生白色沉淀。 |
(3)探究实验II中白色沉淀的成分
查阅资料:CuCl、CuSCN均为白色难溶物,
 ,
, ,
, 与卤素离子性质相似。
与卤素离子性质相似。为了进一步确定白色沉淀的成分,补充如下实验:
在
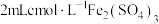 溶液中,加入3滴
溶液中,加入3滴 溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
溶液,再加入足量铜粉,振荡,实验现象与“II”相同。①c=
②该实验中产生白色沉淀的反应分两步,请写出第二步反应的离子方程式。
i.
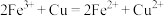 ;
; ii.
③依据以上实验,仍无法确定白色沉淀的组成;还需要将“补充实验”所得混合物进一步实验,即可得出结论。简述操作步骤:
您最近一年使用:0次
3 . LiFePO4可作为新型锂离子电池的正极材料。以精钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4,同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制备LiFePO4,制备流程如图所示:

请回答下列问题:
(1)反应之前先将矿石粉碎的目的是_____ 。
(2)酸溶时钛酸亚铁(FeTiO3)与硫酸反应的化学方程式为_______ 。
(3)①还原步骤中,加过量铁屑,其目的是_______ 。
②滤渣成分的化学式是______
(4)滤渣中的铜提纯后可用于制取Cu2O,工业制取Cu2O的电解池示意图如图,总反应为:2Cu+H2O Cu2O+H2↑。则:
Cu2O+H2↑。则:

①该装置中铜电极应连接直流电源的______ 极。
②石墨电极的电极反应式为_____ 。
③当有0.1molCu2O生成时电路中转移_____ mol电子。

请回答下列问题:
(1)反应之前先将矿石粉碎的目的是
(2)酸溶时钛酸亚铁(FeTiO3)与硫酸反应的化学方程式为
(3)①还原步骤中,加过量铁屑,其目的是
②滤渣成分的化学式是
(4)滤渣中的铜提纯后可用于制取Cu2O,工业制取Cu2O的电解池示意图如图,总反应为:2Cu+H2O
 Cu2O+H2↑。则:
Cu2O+H2↑。则:
①该装置中铜电极应连接直流电源的
②石墨电极的电极反应式为
③当有0.1molCu2O生成时电路中转移
您最近一年使用:0次
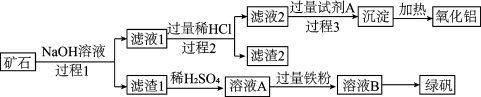
4 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有 、
、 、FeO、
、FeO、 等)来制备绿矾
等)来制备绿矾 和
和 ,其工艺流程如图:
,其工艺流程如图:
回答下列问题:
(1)滤渣1的成分是:___________ (填化学式);过程1发生的化学方程式为___________ 。
(2)过程1、2、3涉及的分离操作为___________ 。
(3)写出由滤液1生成滤渣2的化学方程式为:___________
(4)过程3中加入的过量试剂A为___________ (填试剂名称)。
(5)向溶液A中加入过量铁粉的目的是:___________ ;若将铁粉换为 进行反应,发生的离子方程式为
进行反应,发生的离子方程式为___________ 。
 、
、 、FeO、
、FeO、 等)来制备绿矾
等)来制备绿矾 和
和 ,其工艺流程如图:
,其工艺流程如图:
回答下列问题:
(1)滤渣1的成分是:
(2)过程1、2、3涉及的分离操作为
(3)写出由滤液1生成滤渣2的化学方程式为:
(4)过程3中加入的过量试剂A为
(5)向溶液A中加入过量铁粉的目的是:
 进行反应,发生的离子方程式为
进行反应,发生的离子方程式为
您最近一年使用:0次
5 . 铁及其化合物在生产生活中有重要用途。某化学兴趣小组同学设计以下实验探究铁及其化合物性质。
Ⅰ.氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)
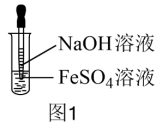
(1) FeSO4可由铁粉还原Fe2(SO4)3制得,反应的离子方程式是:_______ 。
(2)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为_______ 。
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图2。

(3)实验时,先_______ (填“打开”或“关闭”)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后, _______ (填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能持续一段时间不变色。
Ⅱ.“铁与水反应”的实验,并检验产物的性质:

(4)①A装置的作用是_______ B中反应的化学方程式为_______ 。
②D的作用是_______ 。
③点燃E处酒精灯之前应进行的操作是_______ 。
Ⅰ.氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)

(1) FeSO4可由铁粉还原Fe2(SO4)3制得,反应的离子方程式是:
(2)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图2。

(3)实验时,先
Ⅱ.“铁与水反应”的实验,并检验产物的性质:

(4)①A装置的作用是
②D的作用是
③点燃E处酒精灯之前应进行的操作是
您最近一年使用:0次
解题方法
6 . 某工厂废水中含大量 和少量的
和少量的 、
、 、
、 ,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):

(1)“试剂Ⅱ”为_______ ,与“试剂Ⅰ”反应的离子有_______
(2)“红褐色沉淀”为_______ ,“ ”的作用是
”的作用是_______
(3)“试剂Ⅲ”是沉淀“溶液B”中 ,证明“溶液B”中
,证明“溶液B”中 已经完全沉淀的试剂为
已经完全沉淀的试剂为_______ 。
(4)“溶液B”中残留 与“试剂Ⅲ”反应的化学方程式为
与“试剂Ⅲ”反应的化学方程式为_______ 。
(5)“溶液C”在空气中晾晒一段时间后,加盐酸调成弱酸性,蒸发可得工业食盐,但加盐酸时有少量气泡逸出,经检验为 ,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)_______
 和少量的
和少量的 、
、 、
、 ,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
(1)“试剂Ⅱ”为
(2)“红褐色沉淀”为
 ”的作用是
”的作用是(3)“试剂Ⅲ”是沉淀“溶液B”中
 ,证明“溶液B”中
,证明“溶液B”中 已经完全沉淀的试剂为
已经完全沉淀的试剂为(4)“溶液B”中残留
 与“试剂Ⅲ”反应的化学方程式为
与“试剂Ⅲ”反应的化学方程式为(5)“溶液C”在空气中晾晒一段时间后,加盐酸调成弱酸性,蒸发可得工业食盐,但加盐酸时有少量气泡逸出,经检验为
 ,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
您最近一年使用:0次
2022-01-17更新
|
692次组卷
|
2卷引用:四川省达州市2021-2022学年高一上学期期末监测化学试题
名校
解题方法
7 . 高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
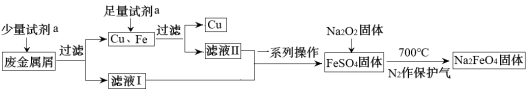
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的实验方法是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中___________ 作还原剂;每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为____________ ,配平该化学方程式,化学计量数从左至右分别为___________ 。
(6)用Na2FeO4代替Cl2处理饮用水的优点是___________ (只答一条即可)。

(1)试剂a为
(2)证明滤液I中无Fe3+的实验方法是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
(6)用Na2FeO4代替Cl2处理饮用水的优点是
您最近一年使用:0次
8 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为_______ 。
② 分离出杂质的操作是_______ 。
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:_______ 。
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为_______ 。
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是_______ 。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为
② 分离出杂质的操作是
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是
您最近一年使用:0次
解题方法
9 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
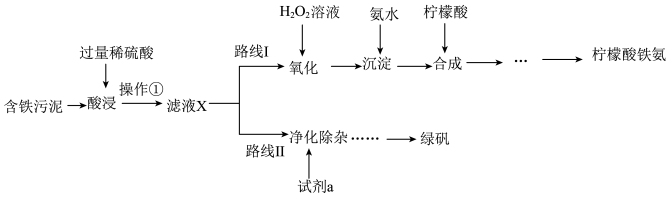
根据所学知识,回答下列问题:
(1)操作①的名称______ ,路线I中,加入H2O2溶液的目的是______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:______ ;检验含有Fe3+的方法是______ 。
(3)“滤液X”中一定含有的阳离子为_______ 。
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_____ ,请写出相应的离子方程式:______ 。

根据所学知识,回答下列问题:
(1)操作①的名称
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
您最近一年使用:0次
名校
解题方法
10 . 化学小组同学学习了Fe3+与Fe反应后,猜想Cu2+也能与Cu发生反应。为了验证猜想,进行实验。
(1)Fe2(SO4)3溶液与Fe反应的离子方程式为___________ 。
(2)[实验探究]
[实验假设]
甲同学分析了实验Ⅰ无明显现象的原因,做出如下假设:
假设a:由于反应温度较低,导致Cu2+氧化性较弱。
假设b:由于___________ ,导致Cu2+氧化性较弱。(补全假设b)
针对上述假设,甲同学继续进行如下实验:
[实验探究]
实验结果:实验Ⅱ和实验Ⅲ中均未检测出Cu+。
(3)[实验探究]
乙同学用CuCl2溶液代替CuSO4溶液进行实验:
实验Ⅳ中发生的离子反应方程式为___________ 。
(4)[实验改进]
乙同学针对实验Ⅰ进行改进,设计并完成实验Ⅴ:向试管a中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
乙同学因此得出结论:Cl−对Cu2+与Cu发生反应有促进作用。
①丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是___________ 。
②丙同学继续设计实验:___________ (填操作和现象),证实了乙同学结论合理。
(5)[结论分析]
综合上述实验可知,Cu2+能否氧化Cu与___________ 有关
(1)Fe2(SO4)3溶液与Fe反应的离子方程式为
(2)[实验探究]
| 实验Ⅰ | 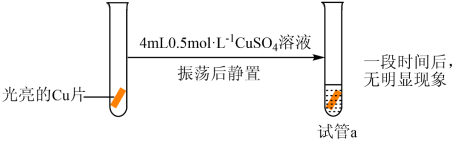 |
甲同学分析了实验Ⅰ无明显现象的原因,做出如下假设:
假设a:由于反应温度较低,导致Cu2+氧化性较弱。
假设b:由于
针对上述假设,甲同学继续进行如下实验:
[实验探究]
| 序号 | 实验 | 加入试剂或操作 |
| 实验Ⅱ |  | 加热试管 |
| 实验Ⅲ | 加入CuSO4固体,振荡 |
(3)[实验探究]
乙同学用CuCl2溶液代替CuSO4溶液进行实验:
| 实验Ⅳ |  |
(4)[实验改进]
乙同学针对实验Ⅰ进行改进,设计并完成实验Ⅴ:向试管a中加入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
乙同学因此得出结论:Cl−对Cu2+与Cu发生反应有促进作用。
①丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是
②丙同学继续设计实验:
(5)[结论分析]
综合上述实验可知,Cu2+能否氧化Cu与
您最近一年使用:0次
2022-02-15更新
|
636次组卷
|
4卷引用:北京市朝阳区2021-2022学年高一上学期期末考试化学试题2



