名校
解题方法
1 . 某工厂的废水中含有大量的 较多的
较多的 和少量的
和少量的 。为了减少污染并变废为宝,某实验小组设计了如下流程制备绿矾(
。为了减少污染并变废为宝,某实验小组设计了如下流程制备绿矾( )并回收金属铜。
)并回收金属铜。

下列叙述错误的是
 较多的
较多的 和少量的
和少量的 。为了减少污染并变废为宝,某实验小组设计了如下流程制备绿矾(
。为了减少污染并变废为宝,某实验小组设计了如下流程制备绿矾( )并回收金属铜。
)并回收金属铜。
下列叙述错误的是
| A.“操作Ⅰ”和“操作Ⅱ”都是过滤 |
| B.“试剂①”为铁粉,“试剂②”为稀盐酸 |
| C.加入“试剂②”时,固体H部分溶解同时有气体生成 |
| D.“溶液G”和“溶液K”都只含一种溶质 |
您最近一年使用:0次
解题方法
2 . 为探索含铝、铁、铜合金(其余成分与酸碱都不反应)废料的再利用,某同学实设计的回收利用方案如下:

(1)写出合金与NaOH溶液反应的离子方程式_______ 。
(2)试剂Y是H2O2溶液,写出生成硫酸铜溶液的化学方程式_______ 。
(3)检验滤液D中含有的金属阳离子的操作:_______ 。
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:_______ 、过滤、洗涤、干燥。
(5)取少量D溶液于试管中,向其滴加NaOH溶液,观察到现象_______ ,对应的离子方程式_______ 。

(1)写出合金与NaOH溶液反应的离子方程式
(2)试剂Y是H2O2溶液,写出生成硫酸铜溶液的化学方程式
(3)检验滤液D中含有的金属阳离子的操作:
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:
(5)取少量D溶液于试管中,向其滴加NaOH溶液,观察到现象
您最近一年使用:0次
名校
3 . 利用废旧镀锌铁皮制备 胶体粒子的流程如图。
胶体粒子的流程如图。

已知:Zn溶于强碱时生成可溶于水的
下列有关说法不正确的是
 胶体粒子的流程如图。
胶体粒子的流程如图。
已知:Zn溶于强碱时生成可溶于水的

下列有关说法不正确的是
A. 是一种复杂的化合物,是具有磁性的黑色晶体 是一种复杂的化合物,是具有磁性的黑色晶体 |
B.滤液中主要存在的离子有 、 、 、 、 |
C.“酸溶”的离子方程式为: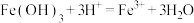 |
D.“氧化”的目的是将 全部氧化为 全部氧化为 |
您最近一年使用:0次
2023-01-16更新
|
476次组卷
|
5卷引用:山东省聊城市2021-2022学年高一上学期期末教学质量抽测化学试题
4 . 请根据如下所示实验过程,回答相关问题:

(1)反应①、②、③中属于氧化还原反应的是___________ 。
(2)向A溶液中滴入几滴KSCN溶液后,可观察到的现象是___________ 。
(3)C的化学式是___________ 。
(4)写出反应①的化学方程式___________ 。写出反应②的离子方程式___________ 。

(1)反应①、②、③中属于氧化还原反应的是
(2)向A溶液中滴入几滴KSCN溶液后,可观察到的现象是
(3)C的化学式是
(4)写出反应①的化学方程式
您最近一年使用:0次
2023-01-16更新
|
159次组卷
|
2卷引用:山东省惠民县第二中学勇进部2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 我国每年的钢产量居世界前列,每年产生大量废铁皮。某科研小组利用本地钢厂所产生的废铁皮,探索制备高纯氧化铁的新工艺。
该废铁皮的化学多元素分析结果如表所示。
制备流程如图所示。
废铁皮 滤液
滤液 Fe(OH)3
Fe(OH)3
 高纯氧化铁
高纯氧化铁
(1)废铁皮在焙烧过程中,单质Fe、C、S都可与 反应,其中Fe与O2反应的化学方程式是
反应,其中Fe与O2反应的化学方程式是_____ 。
(2)在酸溶过程中,为增加溶解速率,可采取的措施是_____ 。
(3)过滤操作得到的滤渣中的成分有H2SiO3、_____ 。
(4)滤液经检验含有Fe2+,检验方案及现象是_____ 。
(5)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
加入氨水以控制溶液的pH在(选填序号)_____ 。
a.3-5 b.6-8 c.9-10
(6)在搅拌过程中,产生Fe(OH)3的反应方程式有_____ 。
(7)对所得高纯氧化铁进行检验,其中Fe2O3含量为95.02%(高于国家一级品技术要求);同时发现还含有0.3%的总钙量(以CaO表示)。产品中含有钙元素的原因是_____ 。
该废铁皮的化学多元素分析结果如表所示。
| 化学成分 | FeO | Fe2O3 | Fe | CaO | CaSiO3 | 其他(C、S等) |
| 含量(%) | 47.35 | 41.92 | 1.07 | 2.64 | 3.48 | 2.68 |
制备流程如图所示。
废铁皮
 滤液
滤液 Fe(OH)3
Fe(OH)3
 高纯氧化铁
高纯氧化铁(1)废铁皮在焙烧过程中,单质Fe、C、S都可与
 反应,其中Fe与O2反应的化学方程式是
反应,其中Fe与O2反应的化学方程式是(2)在酸溶过程中,为增加溶解速率,可采取的措施是
(3)过滤操作得到的滤渣中的成分有H2SiO3、
(4)滤液经检验含有Fe2+,检验方案及现象是
(5)已知:生成氢氧化物沉淀的pH
| Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 6.3 | 1.5 |
| 完全沉淀时 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol•L-1
加入氨水以控制溶液的pH在(选填序号)
a.3-5 b.6-8 c.9-10
(6)在搅拌过程中,产生Fe(OH)3的反应方程式有
(7)对所得高纯氧化铁进行检验,其中Fe2O3含量为95.02%(高于国家一级品技术要求);同时发现还含有0.3%的总钙量(以CaO表示)。产品中含有钙元素的原因是
您最近一年使用:0次
名校
6 . 实验室以锈蚀程度很大的废铁屑为原料制备FeCl3?6H2O晶体的流程可简要表示如图:

已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生主要反应有:①Fe+2H+=Fe2++H2↑;②Fe2O3+6H+=2Fe3++3H2O;③_______ 。
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液后的现象是_______ 。
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是_______ ,为控制该温度可以采用的加热方式为_______ 。
(4)“氧化”过程可在如图所示装置中进行。
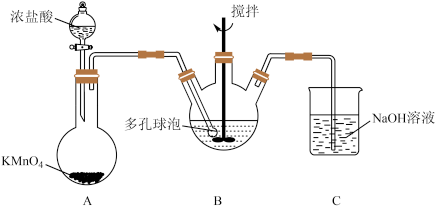
①装置A中KMnO4与浓盐酸反应生成了Cl2,其离子方程式为_______ 。
②B中使用多孔球泡的作用是_______ 。
③证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是_______ 。

已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)向“酸溶”“过滤”后的滤液中滴加KSCN溶液无明显现象,“酸溶”过程中发生主要反应有:①Fe+2H+=Fe2++H2↑;②Fe2O3+6H+=2Fe3++3H2O;③
(2)取少量“酸溶”“过滤”后的滤液,向其中滴加NaOH溶液后的现象是
(3)“酸溶”时控制温度在40℃左右不宜过高,原因是
(4)“氧化”过程可在如图所示装置中进行。

①装置A中KMnO4与浓盐酸反应生成了Cl2,其离子方程式为
②B中使用多孔球泡的作用是
③证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是
您最近一年使用:0次
名校
解题方法
7 . 实验室模拟以磷石膏(含 及杂质
及杂质 、
、 等)为原料制取轻质
等)为原料制取轻质 ,流程如下:
,流程如下:

下列说法错误的是
 及杂质
及杂质 、
、 等)为原料制取轻质
等)为原料制取轻质 ,流程如下:
,流程如下:
下列说法错误的是
A.“浸取1”时,加快搅拌速率、不断升高温度均可提高 的转化率 的转化率 |
B.“浸取1”时,应先通 再通 再通 ,滤液1中浓度最大的阴离子为 ,滤液1中浓度最大的阴离子为 |
C.“浸取2”时,发生反应的离子方程式为 |
D.“浸取2”时,所得滤渣2的主要成分为 、 、 |
您最近一年使用:0次
2023-01-15更新
|
507次组卷
|
5卷引用:山东省聊城市2023届高考一模化学试题
解题方法
8 . 铁是目前用途最广、用量最大的金属。请回答下列问题。
(1)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是_______ ;分离提纯混有NaCl的Fe(OH)3胶体的方法是_______ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的成分为_______ ;
②试剂F宜选用_______ (填选项序号)
A.酸性KMnO4溶液 B.氯水 C.溴水
③往FeCl3腐蚀铜后所得溶液中滴入KSCN溶液呈红色,证明该溶液中含有的金属阳离子是_______ ;
(1)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的成分为
②试剂F宜选用
A.酸性KMnO4溶液 B.氯水 C.溴水
③往FeCl3腐蚀铜后所得溶液中滴入KSCN溶液呈红色,证明该溶液中含有的金属阳离子是
您最近一年使用:0次
解题方法
9 .  是一种晶体,易溶于水,不溶于酒精。工业上用天然二氧化锰与硫化锰矿(含有Fe、Zn、Ni、Si等元素的氧化物)制取
是一种晶体,易溶于水,不溶于酒精。工业上用天然二氧化锰与硫化锰矿(含有Fe、Zn、Ni、Si等元素的氧化物)制取 的一种工艺流程如下。
的一种工艺流程如下。

已知:i、硫化锰矿中 元素主要以
元素主要以 形式存在,
形式存在, 不与硫酸反应。
不与硫酸反应。
ii、除 、
、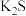 外,金属硫化物一般难溶于水。
外,金属硫化物一般难溶于水。
回答下列问题:
(1)“滤渣①”的主要成分是S和___________ (填化学式)。
(2)“溶浸”所得溶液中既含有 又含有
又含有 ,欲检验溶液中的
,欲检验溶液中的 可选用的试剂是
可选用的试剂是___________ ;试分析“氧化”过程加入 的作用是
的作用是___________ (用离子方程式回答)。
(3)“试剂③”可选用___________ (填化学式)。
(4)“沉锰”过程锰元素转化为碳酸锰,写出“酸溶”过程发生反应的离子方程式___________ 。
(5)最终需经过“过滤、洗涤”等操作得到 ,则洗涤时最好选用
,则洗涤时最好选用___________ (填试剂名称),选用该试剂的理由是___________ 。
 是一种晶体,易溶于水,不溶于酒精。工业上用天然二氧化锰与硫化锰矿(含有Fe、Zn、Ni、Si等元素的氧化物)制取
是一种晶体,易溶于水,不溶于酒精。工业上用天然二氧化锰与硫化锰矿(含有Fe、Zn、Ni、Si等元素的氧化物)制取 的一种工艺流程如下。
的一种工艺流程如下。
已知:i、硫化锰矿中
 元素主要以
元素主要以 形式存在,
形式存在, 不与硫酸反应。
不与硫酸反应。ii、除
 、
、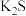 外,金属硫化物一般难溶于水。
外,金属硫化物一般难溶于水。回答下列问题:
(1)“滤渣①”的主要成分是S和
(2)“溶浸”所得溶液中既含有
 又含有
又含有 ,欲检验溶液中的
,欲检验溶液中的 可选用的试剂是
可选用的试剂是 的作用是
的作用是(3)“试剂③”可选用
(4)“沉锰”过程锰元素转化为碳酸锰,写出“酸溶”过程发生反应的离子方程式
(5)最终需经过“过滤、洗涤”等操作得到
 ,则洗涤时最好选用
,则洗涤时最好选用
您最近一年使用:0次
解题方法
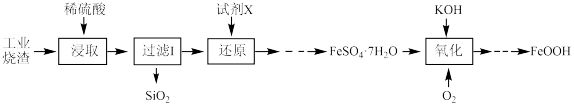
10 . 七水合硫酸亚铁 一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为
一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为 、
、 、
、 等)制取
等)制取 ,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
回答下列问题:
(1)为了提高“浸取”速率,可采取的措施有___________ (填写一种)。
(2)试剂X最好选用___________ (填化学式),“还原”时发生反应的离子方程式为___________ 。
(3)“还原”结束至得到产品 ,应进行的操作依次是
,应进行的操作依次是___________ 、___________ 、过滤、洗涤、干燥。
(4)“氧化”过程发生反应的化学方程式___________ 。
(5)色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为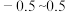 。氧化过程中溶液
。氧化过程中溶液 对产率、色光度的影响如图所示。
对产率、色光度的影响如图所示。

“氧化”时应控制 的范围是
的范围是___________ ;若 过大会导致产品颜色变黑,可能含有的杂质为
过大会导致产品颜色变黑,可能含有的杂质为___________ (填化学式)。
 一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为
一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为 、
、 、
、 等)制取
等)制取 ,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
回答下列问题:
(1)为了提高“浸取”速率,可采取的措施有
(2)试剂X最好选用
(3)“还原”结束至得到产品
 ,应进行的操作依次是
,应进行的操作依次是(4)“氧化”过程发生反应的化学方程式
(5)色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为
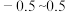 。氧化过程中溶液
。氧化过程中溶液 对产率、色光度的影响如图所示。
对产率、色光度的影响如图所示。
“氧化”时应控制
 的范围是
的范围是 过大会导致产品颜色变黑,可能含有的杂质为
过大会导致产品颜色变黑,可能含有的杂质为
您最近一年使用:0次



