名校
1 . 已知A为淡黄色固体,T为目前使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。______ 。
(2)H在潮湿空气中变成M的实验现象是______ ,化学方程式为______ 。
(3)A和水反应生成B和C的离子方程式为______ 。
(4)反应①的离子方程式为______ ,②加足量T的目的______ ,反应的离子方程式为______ 。

(2)H在潮湿空气中变成M的实验现象是
(3)A和水反应生成B和C的离子方程式为
(4)反应①的离子方程式为
您最近一年使用:0次
解题方法
2 . 价类二维图是学习元素及其化合物知识的重要模型。铁元素的价类二维图如图,下列有关说法不正确的是
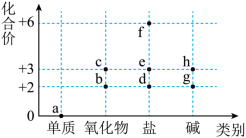
| A.a能导电,能被磁体吸引 | B.铁的氧化物只有b、c |
| C.e转化为f需加入氧化剂 | D.物质g在空气中不能长时间稳定存在 |
您最近一年使用:0次
3 . 高铁酸钾(K2FeO4)是一种高效、无毒的强氧化剂。在工业上,一种通过FeSO4溶液制备K2FeO4的工艺流程如图所示。回答下列问题:
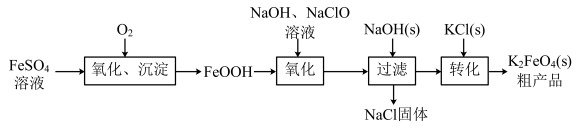
(1)K2FeO4中Fe元素的化合价为_______ 价
(2)“氧化、沉淀”时,氧化剂和还原剂的物质的量之比为_______ 。Fe2+在溶液中放置不稳定,易被氧化成Fe3+,用KSCN溶液检验溶液中的Fe3+是较好的方法,此法的离子方程式为_______ 。
(3)通过“氧化”时FeOOH与NaClO反应生成的Na2FeO4可知,在该条件下物质氧化性:Na2FeO4_______ NaClO(填“>”或“<”)。
(4)写出氢氧化亚铁溶液被空气中氧化为氢氧化铁的化学方程式_______ 。
(5)过滤操作所需要的玻璃仪器有烧杯和_______ 。

(1)K2FeO4中Fe元素的化合价为
(2)“氧化、沉淀”时,氧化剂和还原剂的物质的量之比为
(3)通过“氧化”时FeOOH与NaClO反应生成的Na2FeO4可知,在该条件下物质氧化性:Na2FeO4
(4)写出氢氧化亚铁溶液被空气中氧化为氢氧化铁的化学方程式
(5)过滤操作所需要的玻璃仪器有烧杯和
您最近一年使用:0次
4 . 室温下,反应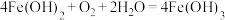 可以自发进行。下列叙述错误的是
可以自发进行。下列叙述错误的是
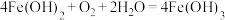 可以自发进行。下列叙述错误的是
可以自发进行。下列叙述错误的是A.该反应 |
| B.该反应有可能是吸热反应 |
| C.反应过程中,白色沉淀逐渐变成灰绿色,最后呈红褐色 |
| D.综合考虑焓变和熵变可以判断反应自发进行的方向 |
您最近一年使用:0次
解题方法
5 . 电子工业中常用覆铜板为基材制作印刷电路板,原理是利用 溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀,使用后的“腐蚀液”可回收利用。回答下列问题。
溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀,使用后的“腐蚀液”可回收利用。回答下列问题。
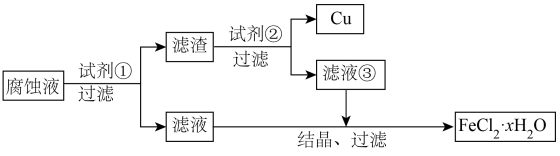
(1) 溶液腐蚀电路板的化学方程式为
溶液腐蚀电路板的化学方程式为___________ 。
(2)过量试剂①为___________ ;过量试剂②为___________ 。
(3)鉴别滤液③中的金属阳离子,应滴加的试剂依次是___________ ,现象是___________ 。 长时间暴露在空气中会变质,主要原因是
长时间暴露在空气中会变质,主要原因是___________ 。
(4)取 滤液③加入试管中,逐滴加入
滤液③加入试管中,逐滴加入 溶液。填写下列表格:
溶液。填写下列表格:
 溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀,使用后的“腐蚀液”可回收利用。回答下列问题。
溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀,使用后的“腐蚀液”可回收利用。回答下列问题。
(1)
 溶液腐蚀电路板的化学方程式为
溶液腐蚀电路板的化学方程式为(2)过量试剂①为
(3)鉴别滤液③中的金属阳离子,应滴加的试剂依次是
 长时间暴露在空气中会变质,主要原因是
长时间暴露在空气中会变质,主要原因是(4)取
 滤液③加入试管中,逐滴加入
滤液③加入试管中,逐滴加入 溶液。填写下列表格:
溶液。填写下列表格:| 序号 | 现象 | 用方程式解释现象 |
| ① | 开始无明显现象 | |
| ② | 稍后出现白色沉淀 |  |
| ③ | 空气中放置一段时间后,出现红褐色沉淀 |
您最近一年使用:0次
6 . A~G为中学化学中常见的物质,转化关系如图所示,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,C是常用的调味剂。E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请据图回答下列问题:
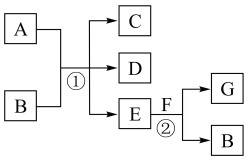
(1)B的化学式___________ ,它的摩尔质量为___________ 。
(2)标况下,等质量的A和G,其分子数之比为:___________ 。
(3)D在水溶液中的电离方程式为___________ 。
(4)F中阴阳离子个数比为:___________ , F可用于呼吸面具和潜水艇中,作为供氧剂,请分析原因___________ 。
(5)请写出反应①的离子反应方程式___________ 。
(6)将B的溶液滴入FeCl2溶液中,先产生白色絮状沉淀,沉淀迅速变为灰绿色,最终变为红褐色,该过程中发生的氧化还原反应的化学方程式为___________ 。

(1)B的化学式
(2)标况下,等质量的A和G,其分子数之比为:
(3)D在水溶液中的电离方程式为
(4)F中阴阳离子个数比为:
(5)请写出反应①的离子反应方程式
(6)将B的溶液滴入FeCl2溶液中,先产生白色絮状沉淀,沉淀迅速变为灰绿色,最终变为红褐色,该过程中发生的氧化还原反应的化学方程式为
您最近一年使用:0次
2024-01-16更新
|
73次组卷
|
2卷引用:四川省泸州市泸县第四中学2023-2024学年高一下学期开学化学试题
解题方法
7 . 过氧化钙 对环境友好,能杀菌消毒净化空气。实验室用大理石为原料制备过氧化钙,反应为
对环境友好,能杀菌消毒净化空气。实验室用大理石为原料制备过氧化钙,反应为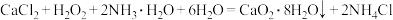 。
。
一、制
I.取适量大理石(含有铁的氧化物等杂质)溶于盐酸,搅拌,至大理石基本完全溶解。
Ⅱ.加水稀释,滴加6%过氧化氢溶液,并用 氨水调节
氨水调节 ,煮沸后趁热过滤,除去
,煮沸后趁热过滤,除去 。
。
Ⅲ.向热滤液中滴加碳酸铵溶液和少量浓氨水,加热搅拌一段时间。
Ⅳ.___________、过滤、洗涤后,将得到的固体置于烧杯中,逐滴加盐酸溶解,产生气泡,并再次煮沸。
二、制
Ⅴ.将Ⅳ所得溶液与过氧化氢、浓氨水混合,放置半小时后抽滤,洗涤, 烘干。
烘干。
回答下列问题:
(1)步骤I中使用的主要玻璃仪器有___________ 。
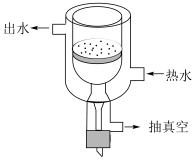
(2)步骤Ⅱ中除去二价铁的相关离子方程式为___________ ;煮沸后需趁热过滤,目的是___________ ;若在该步骤中使用热抽滤漏斗(见下图),比普通过滤的优点是___________ (写两条)。
(3)步骤Ⅲ得到的固体主要是___________ (写化学式)。
(4)步骤Ⅳ经“___________ 、过滤、洗涤”,得到纯净固体后加盐酸,如果不进行再次煮沸,可能造成的影响是___________ 。
(5)关于步骤V的操作,下列方案最合理的是___________ (填序号)。
① 溶液
溶液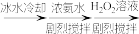
②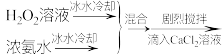
③
 对环境友好,能杀菌消毒净化空气。实验室用大理石为原料制备过氧化钙,反应为
对环境友好,能杀菌消毒净化空气。实验室用大理石为原料制备过氧化钙,反应为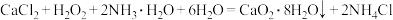 。
。一、制

I.取适量大理石(含有铁的氧化物等杂质)溶于盐酸,搅拌,至大理石基本完全溶解。
Ⅱ.加水稀释,滴加6%过氧化氢溶液,并用
 氨水调节
氨水调节 ,煮沸后趁热过滤,除去
,煮沸后趁热过滤,除去 。
。Ⅲ.向热滤液中滴加碳酸铵溶液和少量浓氨水,加热搅拌一段时间。
Ⅳ.___________、过滤、洗涤后,将得到的固体置于烧杯中,逐滴加盐酸溶解,产生气泡,并再次煮沸。
二、制

Ⅴ.将Ⅳ所得溶液与过氧化氢、浓氨水混合,放置半小时后抽滤,洗涤,
 烘干。
烘干。回答下列问题:
(1)步骤I中使用的主要玻璃仪器有
(2)步骤Ⅱ中除去二价铁的相关离子方程式为

(3)步骤Ⅲ得到的固体主要是
(4)步骤Ⅳ经“
(5)关于步骤V的操作,下列方案最合理的是
①
 溶液
溶液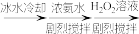
②
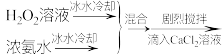
③

您最近一年使用:0次
2024-01-06更新
|
235次组卷
|
2卷引用:2024届四川省成都市高中毕业班第一次诊断性检测理科综合
名校
8 . 下列所示装置正确且能完成相关实验的是
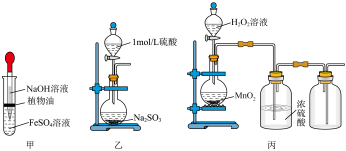
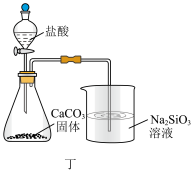
| A.用甲所示装置制取Fe(OH)2 | B.用乙所示装置制取SO2 |
| C.用丙所示装置制取并收集O2 | D.用丁所示装置比较HCl、H2CO3、H2SiO3酸性强弱 |
您最近一年使用:0次
2023-05-12更新
|
150次组卷
|
2卷引用:四川省成都外国语学校2023-2024学年高一下学期3月月考化学试题



