2023·山东青岛·模拟预测
1 . 从铜氨废液{含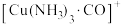 、
、 、NH3、CH3COO-、
、NH3、CH3COO-、 等}中回收铜的工艺流程如图:
等}中回收铜的工艺流程如图:
(1)步骤(Ⅰ)中被氧化的元素是_______ ,由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的_______ (填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,试剂1_______ (化学式)(填NaOH或Na2S),选用该试剂“沉铜”的优点是_______ 。
(3)写出步骤(Ⅳ)“溶解”时的化学方程式:_______ ,步骤(Ⅴ)加入硫酸即可经过滤操作得到硫酸铜晶体的原因是_______ 。
(4)该流程中可以循环利用的物质是_______ (填化学式)。
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为_______ 。
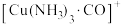 、
、 、NH3、CH3COO-、
、NH3、CH3COO-、 等}中回收铜的工艺流程如图:
等}中回收铜的工艺流程如图:
(1)步骤(Ⅰ)中被氧化的元素是
(2)步骤(Ⅲ)“沉铜”时,试剂1
(3)写出步骤(Ⅳ)“溶解”时的化学方程式:
(4)该流程中可以循环利用的物质是
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为
您最近一年使用:0次
2023·福建漳州·三模
名校
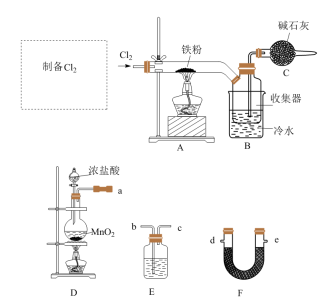
2 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
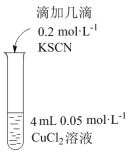
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: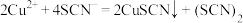 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向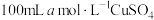 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量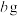 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
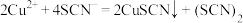 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
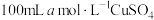 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量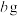 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1012次组卷
|
3卷引用:专题4 创新探究实验中特殊现象——化学学科发展前沿
名校
解题方法
3 . 用粗铜精炼工业中产生的铜阳极泥(主要含Cu2Se、Ag2Se、金和铂等)为原料,回收并制备硝酸铜和硒的工艺流程如图:
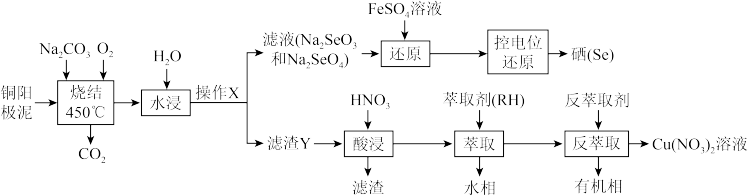
(1)“烧结”时发生如下反应,请完善该反应方程式:___________ 。
 ___
___ _____
_____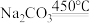 ___
___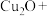 ______
______ _____
_____
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是___________ 。
(2)在实验室,操作X的名称为___________ 。
(3)滤渣Y的成分有Ag2O、_____ (填化学式,下同);已知萃取与反萃取原理为:2RH+Cu2+→R2Cu+2H+,则“反萃取”时反萃取剂最好选用_____ 溶液。
(4)FeSO4的作用是“还原”Na2SeO4制备Na2SeO3,每摩尔Na2SeO4消耗FeSO4的物质的量为___________ mol;常温下,H2SeO3的Ka1=1.0x10-3,Ka2=1.0x10-7;当常温下溶液的pH=4.4时,Na2SeO3溶液中最主要的含Se粒子是___________ 。
(5)“控电位还原”是指在一定电压下,电位高的氧化剂优先被还原,电位低的氧化剂保留在溶液中,以达到硒与杂质金属的分离;下表为一些氧化剂的电位(A/B:A代表氧化剂,B代表还原产物)。
则SeO 、Fe3+和Cu2+的氧化性由强到弱的顺序为
、Fe3+和Cu2+的氧化性由强到弱的顺序为___________ ,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为___________ 。

(1)“烧结”时发生如下反应,请完善该反应方程式:
 ___
___ _____
_____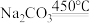 ___
___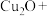 ______
______ _____
_____
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是
(2)在实验室,操作X的名称为
(3)滤渣Y的成分有Ag2O、
(4)FeSO4的作用是“还原”Na2SeO4制备Na2SeO3,每摩尔Na2SeO4消耗FeSO4的物质的量为
(5)“控电位还原”是指在一定电压下,电位高的氧化剂优先被还原,电位低的氧化剂保留在溶液中,以达到硒与杂质金属的分离;下表为一些氧化剂的电位(A/B:A代表氧化剂,B代表还原产物)。
| 名称 | 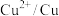 | 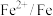 |  |  |
| 电位/V | 0.345 | 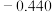 | 0.770 | 0.740 |
 、Fe3+和Cu2+的氧化性由强到弱的顺序为
、Fe3+和Cu2+的氧化性由强到弱的顺序为
您最近一年使用:0次
2022-03-25更新
|
924次组卷
|
4卷引用:四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题四川省内江市2022届高三下学期第二次模拟考试理科综合化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题四川省泸县第一中学2023-2024学年高三上学期期末考试理综试题-高中化学
2021·浙江·模拟预测
4 . 硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:___ 。
(2)下列说法正确的是___ 。
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有___ (写出两条)。
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→___ 。
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是___ 。
④若测得结晶水的含量偏低,则杂质可能是___ 。
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是___ ;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为___ 。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:
(2)下列说法正确的是
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是
④若测得结晶水的含量偏低,则杂质可能是
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是
您最近一年使用:0次
名校
解题方法
5 . 铍铜是广泛应用于制造高级弹性元件的良好合金,某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收和铜两种金属的工艺流程如下:
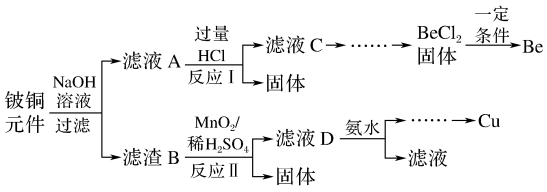
已知:I.铍、铝元素化学性质相似
II.常温下部分难溶物的溶度积常数如下表
(1)滤液A的主要成分除NaOH外,还有____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______ 。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为____ 。
a.加入过量的氨水 b.通入过量的CO2 C.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是_____ 。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___ 。
②若用浓HNO3溶解金属硫化物,缺点是_______ (任写一条)
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于_______ 。
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,
①阴极上得到Be的电极反应式为_____ 。
②电解得到的Be蒸气中约含1%的Na热气除去Be中少量Na的方法为_____ 。
已知部分物质的熔、沸点如下表:

已知:I.铍、铝元素化学性质相似
II.常温下部分难溶物的溶度积常数如下表
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为
a.加入过量的氨水 b.通入过量的CO2 C.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:
②若用浓HNO3溶解金属硫化物,缺点是
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,
①阴极上得到Be的电极反应式为
②电解得到的Be蒸气中约含1%的Na热气除去Be中少量Na的方法为
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
您最近一年使用:0次
2021-01-25更新
|
347次组卷
|
4卷引用:山东师范大学附属中学2020届高三4月化学学习检测化学试题
山东师范大学附属中学2020届高三4月化学学习检测化学试题广东省广州市执信中学2021届高三第二次联考化学试题(已下线)学科网2021年高三3月大联考考后强化卷(新课标Ⅲ卷)(已下线)专题讲座(六)化工流程的解题策略(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
6 . 中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________ 。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________ 。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________ 。
(5)固体混合物B的组成为___________ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(6)煅烧阶段通入惰性气体的原因___________ 。

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)过滤操作需要的玻璃仪器除烧杯外还有
(5)固体混合物B的组成为
(6)煅烧阶段通入惰性气体的原因
您最近一年使用:0次
2019-04-08更新
|
521次组卷
|
9卷引用:【市级联考】宁夏回族自治区银川市2019届高三质量检测理科综合化学试题