1 . 固体化合物由两种元素组成,某小组开展如下探究实验,其中气体A有刺激性气味,能使湿润的红色石蕊试纸变蓝。为探究X的组成,某研究小组进行如下实验:

(1)X的化学式是_______ ;刺激性气体分子电子式_______ ;
(2)X在纯氧中加强热的化学方程式_______ ;
(3)X与稀硫酸的离子反应方程式:_______ ;
(4)为探究固体丙是否是纯净物,请设计简单的实验方案:_______ 。

(1)X的化学式是
(2)X在纯氧中加强热的化学方程式
(3)X与稀硫酸的离子反应方程式:
(4)为探究固体丙是否是纯净物,请设计简单的实验方案:
您最近一年使用:0次
2 . 硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:___ 。
(2)下列说法正确的是___ 。
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有___ (写出两条)。
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→___ 。
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是___ 。
④若测得结晶水的含量偏低,则杂质可能是___ 。
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是___ ;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为___ 。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:
(2)下列说法正确的是
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是
④若测得结晶水的含量偏低,则杂质可能是
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是
您最近一年使用:0次
3 . 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______ (填标号)。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为_______ ,与直接用废铜和浓硫酸反应相比,该方法的优点是_______ 。
(3)待 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量 ,冷却后用
,冷却后用 调
调 为3.5~4,再煮沸
为3.5~4,再煮沸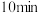 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______ 、乙醇洗涤、_______ ,得到胆矾。其中,控制溶液 为3.5~4的目的是
为3.5~4的目的是_______ ,煮沸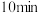 的作用是
的作用是_______ 。
(4)结晶水测定:称量干燥坩埚的质量为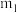 ,加入胆矾后总质量为
,加入胆矾后总质量为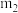 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为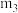 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为_______ (写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是_______ (填标号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
 )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)将
 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为(3)待
 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量 ,冷却后用
,冷却后用 调
调 为3.5~4,再煮沸
为3.5~4,再煮沸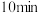 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、 为3.5~4的目的是
为3.5~4的目的是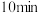 的作用是
的作用是(4)结晶水测定:称量干燥坩埚的质量为
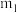 ,加入胆矾后总质量为
,加入胆矾后总质量为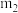 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为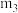 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为(5)下列操作中,会导致结晶水数目测定值偏高的是
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
您最近一年使用:0次
2021-06-11更新
|
18422次组卷
|
28卷引用:解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点10 实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)河北省保定市唐县第一中学2021-2022学年高二下学期期中考试化学试题(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第08讲 金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题45 定量测量类综合实验-备战2023年高考化学一轮复习考点微专题2021年高考全国甲卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第8讲 金属材料(不锈钢、铝合金、合金)(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国甲卷化学试题变式题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)江西省重点校2022-2023学年高三上学期第二次联考化学试题.(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究(已下线)专题03 化学实验专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省驻马店市“逐梦计划”大联考2023-2024学年高二上学期12月期末考试化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
4 . 氯化亚铜(CuCl)可用作有机合成的催化剂,CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液(CuCl+Cl- CuCl
CuCl ),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
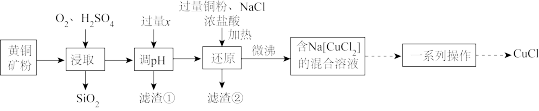
25℃时,相关物质的Ksp见表。
回答下列问题:
(1)黄铜矿预先粉碎的目的是_______ 。
(2)调pH加入的过量x为_______ (填化学式),滤渣①的成分_______ (填化学式)。
(3)“还原”时,铜粉转化为Na[CuCl2]的离子反应方程式为_______ 。
(4)已知:温度、pH对CuCl产率的影响如图1、图2所示。则析出CuCl晶体的最佳条件为_______ 。
A.温度在60℃左右pH为2.0~2.5 B.温度在90℃左右pH为2.0~2.5
C.温度在60℃左右pH为5.0~6.0 D.温度在90℃左右pH为5.0~6.0
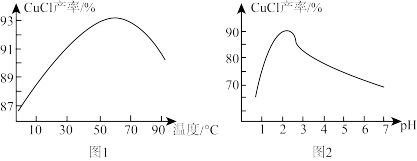
(5)析出的氯化亚铜晶体要立即用无水乙醇洗涤,“醇洗”可快速除去滤渣表面的水,防止滤渣被空气氧化为碱式氯化铜[Cu2(OH)3Cl]。写出氯化亚铜被氧化为碱式氯化铜的化学反应方程式_______ 。
(6)粗产品中氯化亚铜含量的测定:
①称取样品3.0 g于锥形瓶中,再加入过量的FeCl3溶液充分溶解,配制250 mL溶液。②从中取出25.00mL溶液,用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+。
三次平行实验,到达滴定终点时,消耗硫酸铈标准溶液的体积分别为26.05 mL、24.05 mL、23.95 mL。则样品中CuCl的纯度为_______ (结果保留三位有效数字)。
 CuCl
CuCl ),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
25℃时,相关物质的Ksp见表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | CuCl |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-19.7 | 1×10-5.9 |
(1)黄铜矿预先粉碎的目的是
(2)调pH加入的过量x为
(3)“还原”时,铜粉转化为Na[CuCl2]的离子反应方程式为
(4)已知:温度、pH对CuCl产率的影响如图1、图2所示。则析出CuCl晶体的最佳条件为
A.温度在60℃左右pH为2.0~2.5 B.温度在90℃左右pH为2.0~2.5
C.温度在60℃左右pH为5.0~6.0 D.温度在90℃左右pH为5.0~6.0
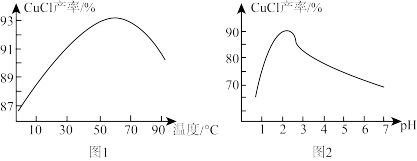
(5)析出的氯化亚铜晶体要立即用无水乙醇洗涤,“醇洗”可快速除去滤渣表面的水,防止滤渣被空气氧化为碱式氯化铜[Cu2(OH)3Cl]。写出氯化亚铜被氧化为碱式氯化铜的化学反应方程式
(6)粗产品中氯化亚铜含量的测定:
①称取样品3.0 g于锥形瓶中,再加入过量的FeCl3溶液充分溶解,配制250 mL溶液。②从中取出25.00mL溶液,用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+。
三次平行实验,到达滴定终点时,消耗硫酸铈标准溶液的体积分别为26.05 mL、24.05 mL、23.95 mL。则样品中CuCl的纯度为
您最近一年使用:0次
2021-05-08更新
|
696次组卷
|
7卷引用:考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)江西省南昌市八一中学2021届高三第三次模拟考试理科综合化学试题(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省大庆市2021届高三下学期(4月)第二次教学质量监测(二模)化学试题宁夏石嘴山市第三中学2021届高三第四次模拟考试化学试题(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
解题方法
5 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。
取一定量的NaOH溶液、CuSO4溶液和甲醛于锥形瓶,控制温度40-50℃回流1h,收集到大量气体X,并有红色沉淀生成。
(1)①“控制温度40-50℃”的常用加热方法是_______ 。
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是_______ 。
(2)在探究甲醛的氧化产物时,发现未生成 。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
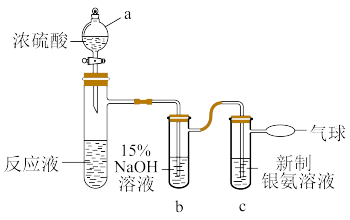
①仪器a的名称是_______ 。
②b中,NaOH溶液的作用是_______ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为_______ 。
(3)① 没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是
没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是_______ 。
②另取1.00g红色沉淀,用适量稀盐酸、双氧水溶解完全,加热煮沸溶液4-5min,冷却后加入过量的碘化钾溶液和淀粉指示剂,再用1.000 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液15.50mL。因此,红色沉淀中Cu单质的质量分数
_______ (结果保留3位有效数字;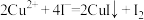 ;
;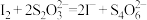 。)
。)
(4)若最终测得沉淀中Cu单质和气体产物物质的量比为1∶1,该条件下甲醛与新制氢氧化铜发生的主要反应化学方程式为_______ 。
取一定量的NaOH溶液、CuSO4溶液和甲醛于锥形瓶,控制温度40-50℃回流1h,收集到大量气体X,并有红色沉淀生成。
(1)①“控制温度40-50℃”的常用加热方法是
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是
(2)在探究甲醛的氧化产物时,发现未生成
 。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,NaOH溶液的作用是
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(3)①
 没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是
没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是②另取1.00g红色沉淀,用适量稀盐酸、双氧水溶解完全,加热煮沸溶液4-5min,冷却后加入过量的碘化钾溶液和淀粉指示剂,再用1.000 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液15.50mL。因此,红色沉淀中Cu单质的质量分数

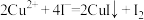 ;
;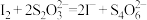 。)
。)(4)若最终测得沉淀中Cu单质和气体产物物质的量比为1∶1,该条件下甲醛与新制氢氧化铜发生的主要反应化学方程式为
您最近一年使用:0次
2021-04-10更新
|
802次组卷
|
3卷引用:第16讲 醛和酮(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)
(已下线)第16讲 醛和酮(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)广东省广州市广东实验中学2023届高三上学期第二次阶段考试化学试题福建省福州市2021届高中毕业班4月质量检测化学试题
6 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为ZnO,并含少量的CuO、MnO2、Fe2O3等)为原料制备氧化锌的工艺流程如下:
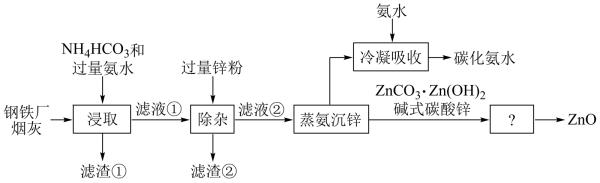
回答下列问题:
(1)“浸取”工序中加入过量氨水的目的:①使ZnO、CuO溶解,转化为[Zn(NH3)4]2+和[Cu(NH3)4]2+配离子;②______ 。
(2)ZnO转化反应的离子方程式为______ 。
(3)“除杂”工序中,反应的离子方程式为______ 。
(4)滤渣②的主要成分有______ (填化学式),回收后可用作冶金原料。
(5)“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,相应的化学方程式为______ ,蒸出物冷凝吸收后得到的碳化氨水可返回______ 工序循环使用。
(6)从碱式碳酸锌得到氧化锌的工序名称为______ 。
(7)将滤渣①用H2SO4溶液处理后得到______ 溶液和______ 固体(均填化学式)。

回答下列问题:
(1)“浸取”工序中加入过量氨水的目的:①使ZnO、CuO溶解,转化为[Zn(NH3)4]2+和[Cu(NH3)4]2+配离子;②
(2)ZnO转化反应的离子方程式为
(3)“除杂”工序中,反应的离子方程式为
(4)滤渣②的主要成分有
(5)“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,相应的化学方程式为
(6)从碱式碳酸锌得到氧化锌的工序名称为
(7)将滤渣①用H2SO4溶液处理后得到
您最近一年使用:0次
2021-01-25更新
|
1786次组卷
|
5卷引用:专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练
(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练河北省2021年普通高中学业水平选择考适应性测试化学试题(已下线)大题01 化学工艺流程题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)难点2 无机工艺流程中的操作分析-2021年高考化学【热点·重点·难点】专练(新高考)山西省怀仁市第一中学2021-2022学年高三上学期第二次月考理科综合化学试题
名校
7 . 我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾(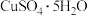 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:

已知: 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.
请回答下列问题:
(1)仪器a的名称是____ ,a中的棒香能复燃,说明热分解产物含有_____ (填化学式)。
(2)A中固体由蓝色变为黑色,B中的现象是____ 。
(3)C中冰水的作用是_____ 。
(4)D中品红溶液褪色,E中有 、
、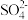 生成,写出E中生成
生成,写出E中生成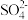 的总的离子方程式:
的总的离子方程式:____ 。
(5)若生成 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为_____ 。
(6)小组同学用滴定法测定某胆矾样品中 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(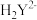 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: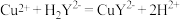 )。
)。
①样品中 的质量分数为
的质量分数为____ %(用含m、V的代数式表示)。
②下列操作会导致 含量的测定结果偏高的是
含量的测定结果偏高的是____ (填选项字母)。
a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
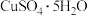 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:
已知:
 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.请回答下列问题:
(1)仪器a的名称是
(2)A中固体由蓝色变为黑色,B中的现象是
(3)C中冰水的作用是
(4)D中品红溶液褪色,E中有
 、
、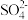 生成,写出E中生成
生成,写出E中生成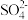 的总的离子方程式:
的总的离子方程式:(5)若生成
 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为(6)小组同学用滴定法测定某胆矾样品中
 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(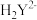 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: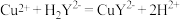 )。
)。①样品中
 的质量分数为
的质量分数为②下列操作会导致
 含量的测定结果偏高的是
含量的测定结果偏高的是a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
您最近一年使用:0次
2019-04-26更新
|
774次组卷
|
3卷引用:一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题【市级联考】湖南省益阳市2019届高三下学期4月模考理科综合化学试题
8 . 某课题组同学受葡萄糖与新制氢氧化铜悬浊液反应实验的启示,拟设计实验利用氧化铜探究乙醛的还原性。
【提出猜想】 猜想 1: CH3CHO+2CuO CH3COOH+Cu2O;
CH3COOH+Cu2O;
猜想 2:_______________________ (写出化学方程式)。
【定性实验】(1)甲同学设计下图装置进行实验(部分夹持装置已略去):
已知: 乙醛和乙酸的沸点分别为 20.8℃、 117.9℃。
按上述装置进行实验,当氧化铜完全反应后停止实验。
①为达到良好的冷凝效果,方框中 C 装置应选用_________ (填仪器名称);实验中先通入乙醛蒸气,后点燃装置 B 处酒精灯,这样操作的目的是_________ 。
②已知: Cu2O 呈红色,在酸性条件下发生反应 Cu2O+2H+=Cu+Cu2++H2O。 请你设计实验证明猜想 1 成立。
实验操作:____________________________________ 。
实验现象:____________________________________ 。
【定量实验】(2)乙同学设计了如下图所示实验方案定量探究红色固体的成分。
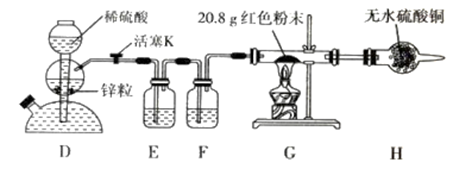
已知:醋酸亚铬[Cr(CH3COO)2]溶液可以吸收少量的 O2。
①下列有关说法正确的是(填标号)_______ 。
a. 装置 D 可以控制反应的发生与停止
b. 装置 F 中盛装醋酸亚铬溶液
c. 向装置 D 中加入少量硫酸铜固体可加快反应
d. 实验中观察到装置 G 中有明显现象
②装置 G 中红色粉末完全反应后,称得固体粉末质量为 19.2 g;装置 H 净增质量为2.0 g。请选择合理数据计算,确定红色粉末的成分及物质的量:_______ 。
【提出猜想】 猜想 1: CH3CHO+2CuO
 CH3COOH+Cu2O;
CH3COOH+Cu2O;猜想 2:
【定性实验】(1)甲同学设计下图装置进行实验(部分夹持装置已略去):

已知: 乙醛和乙酸的沸点分别为 20.8℃、 117.9℃。
按上述装置进行实验,当氧化铜完全反应后停止实验。
①为达到良好的冷凝效果,方框中 C 装置应选用
②已知: Cu2O 呈红色,在酸性条件下发生反应 Cu2O+2H+=Cu+Cu2++H2O。 请你设计实验证明猜想 1 成立。
实验操作:
实验现象:
【定量实验】(2)乙同学设计了如下图所示实验方案定量探究红色固体的成分。

已知:醋酸亚铬[Cr(CH3COO)2]溶液可以吸收少量的 O2。
①下列有关说法正确的是(填标号)
a. 装置 D 可以控制反应的发生与停止
b. 装置 F 中盛装醋酸亚铬溶液
c. 向装置 D 中加入少量硫酸铜固体可加快反应
d. 实验中观察到装置 G 中有明显现象
②装置 G 中红色粉末完全反应后,称得固体粉末质量为 19.2 g;装置 H 净增质量为2.0 g。请选择合理数据计算,确定红色粉末的成分及物质的量:
您最近一年使用:0次



