12-13高三上·湖北荆门·阶段练习
名校
1 . CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
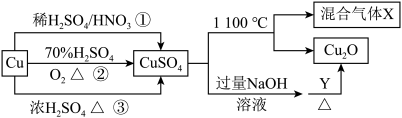

| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol |
| D.Y可以是葡萄糖 |
您最近一年使用:0次
2019-01-30更新
|
1652次组卷
|
22卷引用:2013届湖北省荆门市龙泉中学高三10月月考化学试卷
(已下线)2013届湖北省荆门市龙泉中学高三10月月考化学试卷2013届河北省衡水中学高三第二次模拟考试化学试卷12013届河北省衡水中学高三第二次模拟考试化学试卷 22016届四川省成都外国语学校高三上学期10月月考化学试卷2016届黑龙江省哈尔滨六中高三下开学考理综化学试卷2015-2016学年福建省龙海二中高二下学期期末化学试卷2015-2016学年湖南师大附中高一下学期末化学试卷黑龙江省哈尔滨市第六中学2016-2017学年高二下学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【全国校级联考】辽宁省六校协作体2017-2018学年高二下学期6月联考化学试题【全国百强校】四川省绵阳市南山中学2017-2018学年高一下学期期末模拟考试(6月)化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高一下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第4讲 用途广泛的金属材料及开发利用金属矿物【押题专练】四川省成都市外国语学校2019届高三上学期开学考试化学试题第八章 化学与可持续发展 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)第四章 化学与自然资源的开发利用 模拟高考——C挑战区 夯实基础(人教版必修2)黑龙江省牡丹江市第一高级中学2020-2021学年高二上学期8月开学考试化学试题必修第二册RJ第八章 C挑战区 模拟高考陕西省西安市长安区第一中学2021届高三上学期第二次月考化学试题广西南宁市邕宁高中2020-2021学年高一下学期期末考试化学试题(已下线)第10讲 金属材料及金属矿物的开发利用(精练)-2022年高考化学一轮复习讲练测(已下线)第5讲 金属材料与金属的冶炼
解题方法
2 . 向13.6g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.25 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入0.5 mol/L的NaOH溶液1 L,反应后溶液恰好呈中性,金属离子已完全沉淀,沉淀质量为19.6 g,下列说法不正确的是
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2 mol/L |
| C.Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5 mol |
| D.产生的NO在标准状况下的体积为2.24 L |
您最近一年使用:0次
解题方法
3 . uCl是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3,含FeS、FeO和SiO2杂质)制备CuCl的某流程如图:

请回答:
(1)步骤②中涉及的主要离子反应方程式为__________
(2)步骤⑤中涉及的主要离子反应方程式为___________
(3)下列说法不正确 的是___________
A. 步骤①中产生的气体的主要成分为CO2和H2S气体
B. 滤渣1的成分为SiO2,滤渣2的主要成分为Fe(OH)3和Cu(OH)2
C. CO32-作用是控制溶液pH,促使CuCl沉淀的生成
D.若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32- /CO32-的溶液中,同样可制取CuCl

请回答:
(1)步骤②中涉及的主要离子反应方程式为
(2)步骤⑤中涉及的主要离子反应方程式为
(3)下列说法
A. 步骤①中产生的气体的主要成分为CO2和H2S气体
B. 滤渣1的成分为SiO2,滤渣2的主要成分为Fe(OH)3和Cu(OH)2
C. CO32-作用是控制溶液pH,促使CuCl沉淀的生成
D.若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32- /CO32-的溶液中,同样可制取CuCl
您最近一年使用:0次
解题方法
4 . 向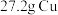 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是
①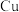 与
与 的物质的量之比为
的物质的量之比为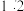
②硝酸的物质的量浓度为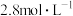
③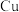 、
、 与硝酸反应后剩余
与硝酸反应后剩余 为
为
④产生的 的体积为
的体积为
⑤原混合物中Cu的质量分数为
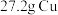 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是①
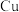 与
与 的物质的量之比为
的物质的量之比为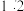
②硝酸的物质的量浓度为
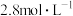
③
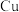 、
、 与硝酸反应后剩余
与硝酸反应后剩余 为
为
④产生的
 的体积为
的体积为
⑤原混合物中Cu的质量分数为

| A.①⑤ | B.②④ | C.①④ | D.②③ |
您最近一年使用:0次
2020-01-26更新
|
3146次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(强化练)
解题方法
5 . 某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
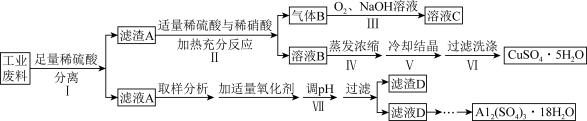
请回答:
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________ 。

(2)写出步骤Ⅱ中发生反应的离子方程式___________________ 。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________ 。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________ 。
(4)下列有关实验说法正确的是___________________ 。
A.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B.步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a
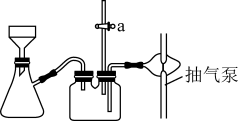
C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样ag溶于20mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mLZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666gmol-1,EDTA分别能与Al3+或Zn2+以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________ (用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________ 。

请回答:
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是

(2)写出步骤Ⅱ中发生反应的离子方程式
(3)步骤Ⅳ蒸发浓缩的具体操作是
(4)下列有关实验说法正确的是
A.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B.步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a

C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样ag溶于20mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mLZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666gmol-1,EDTA分别能与Al3+或Zn2+以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为
您最近一年使用:0次
12-13高三上·陕西咸阳·期末
6 . 有一铁粉和氧化铜的混合物6.96g,进行如下实验:
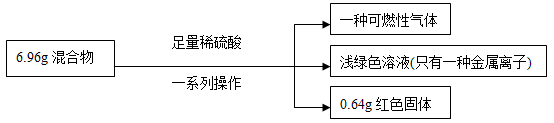
根据实验所得数据,关于混合物相关说法正确的是

根据实验所得数据,关于混合物相关说法正确的是
| A.生成气体质量为0.2g |
| B.原混合物中铁的质量分数无法计算 |
| C.实验中反应的H2SO4质量为10.78g |
| D.原混合物中铜元素的质量不一定为0.64g |
您最近一年使用:0次
14-15高三上·辽宁·期中
解题方法
7 . CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法不正确的是
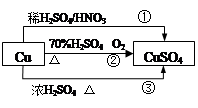
(已知:2Cu O2
O2 2H2SO4=2CuSO4
2H2SO4=2CuSO4 2H2O)
2H2O)
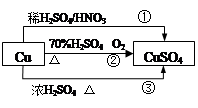
(已知:2Cu
 O2
O2 2H2SO4=2CuSO4
2H2SO4=2CuSO4 2H2O)
2H2O)| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
您最近一年使用:0次
8 . 铜钱在历史上曾经是一种广泛流通的货币。从物理性质和化学性质的角度分析,铜常用于制造货币的说法正确的是
| A.铜来源广泛,易于从自然界冶炼得到 |
| B.铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型 |
| C.铜的外观为紫红色,大方美观,易于被人们接受 |
| D.铜的化学性质不稳定,在空气中易转化为铜绿,铜绿具有抗腐蚀能力,易于流通 |
您最近一年使用:0次
2016-11-17更新
|
344次组卷
|
3卷引用:2017届吉林省汪清六中高三上第二次月考化学试卷
2017届吉林省汪清六中高三上第二次月考化学试卷人教版(2019)高中化学必修第二册第九章《化学与可持续发展》测试题(已下线)3.3.3 用途广泛的金属材料(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)
名校
解题方法
9 . 工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示:
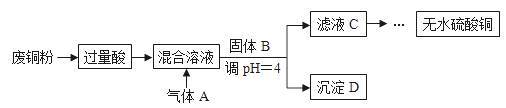
下列有关说法不正确的是

下列有关说法不正确的是
| A.“过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 |
| B.通入的气体A可以是O2或Cl2 |
| C.通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+[ |
| D.将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜 |
您最近一年使用:0次
2016-12-09更新
|
733次组卷
|
6卷引用:2016届浙江省嘉兴市高三一模理综化学试卷
2016届浙江省嘉兴市高三一模理综化学试卷2015-2016学年贵州省习水一中高一下学期期中考试化学试卷江西省景德镇市第一中学2016-2017学年高二(素质班)下学期期末考试化学试题(已下线)专题六 元素化合物的性质、应用及转化(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题09 化工流程选择(精选)-2021年高考化学必做热点专题广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题
10 . 自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是
| A.原生铜的硫化物具有还原性 |
| B.常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 |
C.铜蓝的形成过程是:ZnS(s)+Cu2+ CuS(s)+Zn2+ CuS(s)+Zn2+ |
| D.硝酸型酸雨不利于铜蓝的形成:CuS+2H+=Cu2++H2S↑ |
您最近一年使用:0次
2016-12-09更新
|
207次组卷
|
2卷引用:2016届北京市朝阳区高三上学期期末统考化学试卷



