名校
解题方法
1 . 10℃时,分别向4支小试管中滴加8滴1mol/LCuSO4溶液,再分别向其中滴加2mol/LNaOH溶液,边滴加边振荡,实验数据及现象如下表:
取浅绿色沉淀用蒸馏水反复洗涤,加入稀盐酸完全溶解,再加入适量BaCl2溶液,产生大量白色沉淀。取蓝色沉淀重复上述实验,无白色沉淀。经检验,试管3、4中黑色沉淀中含有CuO。
下列说法不正确 的是
| 试管编号 | 1 | 2 | 3 | 4 |
| 滴加NaOH溶液的量 | 2滴 | 6滴 | 12滴 | 16滴 |
| 立即观察沉淀的颜色 | 浅绿色 | 浅绿色 | 蓝色 | 蓝色 |
| 酒精灯加热浊液后沉淀的颜色 | 浅绿色 | 浅绿色 | 黑色 | 黑色 |
下列说法
| A.由实验现象可知浅绿色沉淀中可能含有碱式硫酸铜 |
| B.CuSO4溶液与NaOH溶液反应时,其相对量不同可以得到不同的产物 |
C.试管3、4中的固体在加热过程中发生了反应:Cu(OH)2 CuO+H2O CuO+H2O |
| D.取浅绿色沉淀再滴加适量NaOH溶液后加热仍不会变黑 |
您最近一年使用:0次
2021-05-10更新
|
962次组卷
|
6卷引用:2020年北京高考化学真题变式题11-19
2020年北京高考化学真题变式题11-19北京市西城区2021届高三化学第二次模拟考试(已下线)第三章能力提升检测卷-2022年高考化学一轮复习讲练测北京市第二十二中学2021-2022学年高三上学期期中考试化学试题北京市房山区2022-2023学年高三上学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高三下学期零模化学试题
名校
解题方法
2 . 铍铜是广泛应用于制造高级弹性元件的良好合金,某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收和铜两种金属的工艺流程如下:
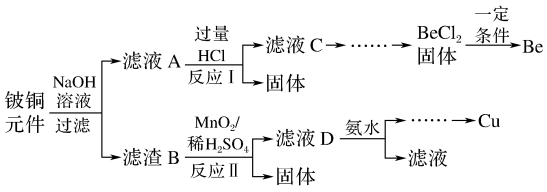
已知:I.铍、铝元素化学性质相似
II.常温下部分难溶物的溶度积常数如下表
(1)滤液A的主要成分除NaOH外,还有____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______ 。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为____ 。
a.加入过量的氨水 b.通入过量的CO2 C.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是_____ 。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___ 。
②若用浓HNO3溶解金属硫化物,缺点是_______ (任写一条)
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于_______ 。
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,
①阴极上得到Be的电极反应式为_____ 。
②电解得到的Be蒸气中约含1%的Na热气除去Be中少量Na的方法为_____ 。
已知部分物质的熔、沸点如下表:

已知:I.铍、铝元素化学性质相似
II.常温下部分难溶物的溶度积常数如下表
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为
a.加入过量的氨水 b.通入过量的CO2 C.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:
②若用浓HNO3溶解金属硫化物,缺点是
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,
①阴极上得到Be的电极反应式为
②电解得到的Be蒸气中约含1%的Na热气除去Be中少量Na的方法为
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
您最近一年使用:0次
2021-01-25更新
|
348次组卷
|
4卷引用:山东师范大学附属中学2020届高三4月化学学习检测化学试题
山东师范大学附属中学2020届高三4月化学学习检测化学试题广东省广州市执信中学2021届高三第二次联考化学试题(已下线)学科网2021年高三3月大联考考后强化卷(新课标Ⅲ卷)(已下线)专题讲座(六)化工流程的解题策略(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
3 . 一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜晶体的工艺流程如图所示;请回答下列问题:
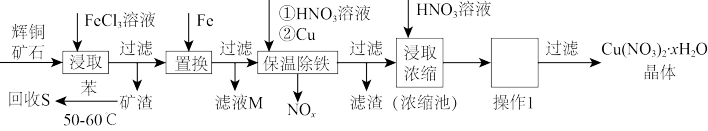
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_______ 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②_______ 。
(3)“回收S”的过程中,温度控制在50-60℃,不宜过高,原因是_______ 。
(4)向滤液M中加入(或通入)_______ (填字母),所得物质可循环利用。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是____ ;向浓缩池中加入适量HNO3的作用是____ 。操作I是____ 。

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②
(3)“回收S”的过程中,温度控制在50-60℃,不宜过高,原因是
(4)向滤液M中加入(或通入)
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是
您最近一年使用:0次
2020-12-29更新
|
275次组卷
|
3卷引用:广东省广州市第七中学2021届高三11月月考化学试题
20-21高三上·浙江绍兴·期中
解题方法
4 . I.由三种元素组成的化合物A,其相对分子质量小于200,按如下流程进行实验。气体B为红棕色混合物,气体D能使带火星的木条复燃,溶液E为蓝色,固体C为混合物,固体F为紫红色。
(1)组成A的三种元素是_______ 。(填元素符号),A的化学式是________ 。
(2)固体A加热分解的化学方程式是________ 。
(3)若固体G的组成与A类似,且隔绝空气加热后红棕色气体与带火星木条复燃气体的物质的量为8:1,该反应的化学方程式是。___________ 。
II.某兴趣小组为制取并验证二氧化硫的性质进行相关实验,实验装置如图所示。请回答:___________ 。
(2)写出烧杯中过量的NaClO溶液吸收SO2的离子反应方程式___________ 。

(1)组成A的三种元素是
(2)固体A加热分解的化学方程式是
(3)若固体G的组成与A类似,且隔绝空气加热后红棕色气体与带火星木条复燃气体的物质的量为8:1,该反应的化学方程式是。
II.某兴趣小组为制取并验证二氧化硫的性质进行相关实验,实验装置如图所示。请回答:
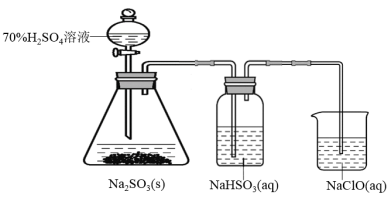
(2)写出烧杯中过量的NaClO溶液吸收SO2的离子反应方程式
您最近一年使用:0次
名校
解题方法
5 . 氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究。下列说法不正确的是
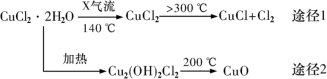
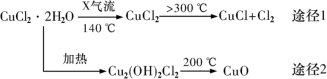
| A.途径1中产生的Cl2可以回收循环利用 |
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
C.CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++SO =2Cu2++2Cl-+SO2↑+2H2O =2Cu2++2Cl-+SO2↑+2H2O |
| D.X气体是HCl,目的是抑制CuCl2•2H2O加热过程可能的水解 |
您最近一年使用:0次
2021-03-17更新
|
479次组卷
|
14卷引用:江西省南昌市第二中学2020届高三第四次月考化学试题
江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题浙江省宁波市效实中学2020届高三上学期第一次模拟考试化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题江西省南昌市进贤一中2019-2020学年高一上学期第二次月考化学试题2020届高三《新题速递·化学》12月第02期(考点01-06)黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫浙江省宁波市慈溪市2021届高三适应性测试化学试题北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题浙江省淳安县汾口中学2020-2021学年高二3月月考化学试题江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题
解题方法
6 . 铜广泛应用于电气、轻工、机械制造、国防工业等。回答下列问题:
(1)用黄铜矿冶铜原理如图所示:

①反应Ⅱ中每消耗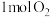 转移电子的物质的量为
转移电子的物质的量为______ 。
②反应Ⅲ的化学方程式为______ 。
(2)铜锈中有无害的 和有害的“粉状锈”
和有害的“粉状锈” 。
。
① 和
和 均属于
均属于______ 填“正”“酸式”或“碱式")盐; 在湿的空气中生成
在湿的空气中生成 的化学方程式为
的化学方程式为______ 。
②某铜锈样品可能由 、
、 和
和 组成,测定其组成的步骤如图所示,则铜锈样品中
组成,测定其组成的步骤如图所示,则铜锈样品中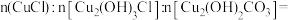
______ 。
(1)用黄铜矿冶铜原理如图所示:

①反应Ⅱ中每消耗
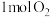 转移电子的物质的量为
转移电子的物质的量为②反应Ⅲ的化学方程式为
(2)铜锈中有无害的
 和有害的“粉状锈”
和有害的“粉状锈” 。
。①
 和
和 均属于
均属于 在湿的空气中生成
在湿的空气中生成 的化学方程式为
的化学方程式为②某铜锈样品可能由
 、
、 和
和 组成,测定其组成的步骤如图所示,则铜锈样品中
组成,测定其组成的步骤如图所示,则铜锈样品中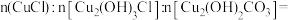

您最近一年使用:0次
名校
解题方法
7 . 现有 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到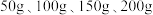 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表:
(1) 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为______ g。
(2)试求出混合溶液中 的溶质质量分数是
的溶质质量分数是______ ?(写出计算过程)
(3)混合溶液中 的溶质质量分数为
的溶质质量分数为______ 。
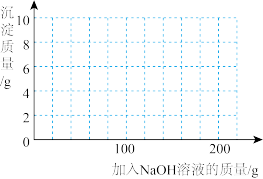
(4)若在 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图______ 。(在答题卡的坐标图中作图)
 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到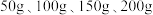 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表: | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
 溶液的质量 溶液的质量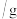 | 50 | 100 | 150 | 200 |
生成沉淀的质量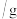 | 0 | 2.45 | 7.35 | 9.8 |
(1)
 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为(2)试求出混合溶液中
 的溶质质量分数是
的溶质质量分数是(3)混合溶液中
 的溶质质量分数为
的溶质质量分数为(4)若在
 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图
您最近一年使用:0次
解题方法
8 . 为了探究某不带结晶水的固X体(含四种元素,200g•mol -1<M<300g•mol-1 )的组成,设计并完成了如图实验:
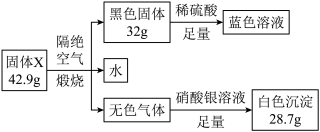
请回答:
(1)固体X中含有的元素是H、O、_____ ,水的质量为__________ g。
(2)蓝色溶液中加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子反应方程式_______ 。
(3)X的化学式是________________ 。

请回答:
(1)固体X中含有的元素是H、O、
(2)蓝色溶液中加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子反应方程式
(3)X的化学式是
您最近一年使用:0次
名校
解题方法
9 . 绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:___________ ;
(2)过程②对应的化学方程式是:___________ 。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2 +I2=
+I2= +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________ ;
(4)醋酸铜产品中铜元素的质量分数是_______ 。
Ⅰ.醋酸铜晶体的制备中

(1)用离子方程式表示过程①产物中OH-的来源:
(2)过程②对应的化学方程式是:
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2
 +I2=
+I2= +2I-)
+2I-)iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是
(4)醋酸铜产品中铜元素的质量分数是
您最近一年使用:0次
10 . CuCl常用作催化剂,石油工业中脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。某课外学习小组用辉铜矿(主要成分为Cu2S,少量的Fe2O3和SiO2)制取氯化亚铜的流程如下:
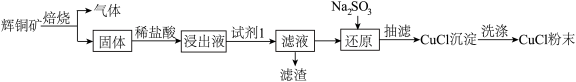
(1)“焙烧”过程发生反应的化学方程式___________ ;为加快浸取速率常采取的措施___________ (写两条)。
(2)加入“试剂1”可调节浸出液的pH,“试剂1”可以是___________ ;“滤渣”的成分是___________ (填化学式)。
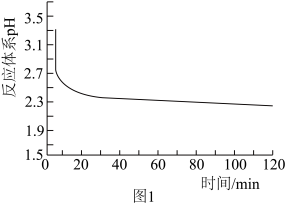

(3)①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式___________ 。
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是_________ 。
(4)反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是___________ 。
(5)CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是_______ 。
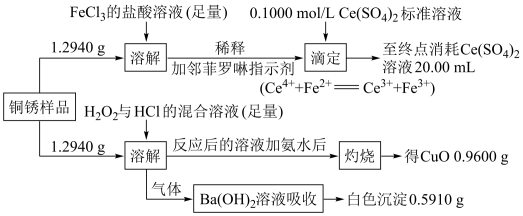
(6)取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为___________ 。

(1)“焙烧”过程发生反应的化学方程式
(2)加入“试剂1”可调节浸出液的pH,“试剂1”可以是


(3)①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是
(4)反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是
(5)CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是
(6)取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为
您最近一年使用:0次



