1 . 将3.84gCu和一定量的浓HNO3反应,随着反应的进行,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体2.24L(标准状况,不考虑NO2转化成N2O4),则反应中消耗HNO3的物质的量为
| A.1mol | B.0.05mol | C.0.11mol | D.0.22mol |
您最近一年使用:0次
名校
2 . 下列有关含硫物质转化判断正确的是
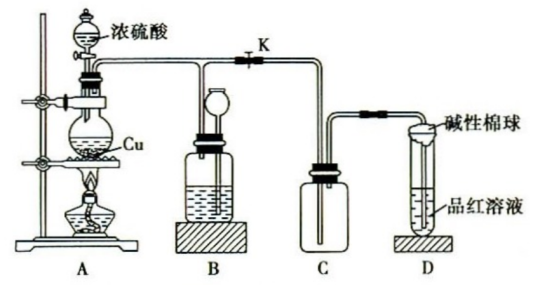

| A.0.1 mol Cu与足量的硫充分反应,生成物的质量比该单质的质量增加了1.6 g |
| B.如图是铜与浓硫酸反应的实验装置。B中盛装的是浓硫酸,作用是干燥SO2 |
| C.Cu投入稀硫酸中加热,没有明显变化,加入一定量的H2O2溶液,金属Cu逐渐溶解,反应中H2O2起催化作用 |
| D.向铜与浓硫酸反应后的混合溶液中加水,判断有无铜离子 |
您最近一年使用:0次
2021-02-03更新
|
705次组卷
|
4卷引用:江西省南昌市第二中学2020-2021学年高一上学期期末考试化学试题
江西省南昌市第二中学2020-2021学年高一上学期期末考试化学试题湖北省黄梅国际育才高级中学2020-2021学年高一下学期3月月考化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省江门市新会一中2022-2023学年高一下学期期末考试化学试题
名校
3 . 一定温度下,探究铜与稀HNO3,反应过程如图,下列说法不正确的是( )
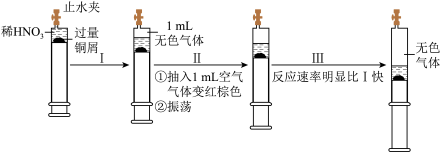

| A.步骤Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大 |
| B.由实验可知,NO2对该反应具有催化作用 |
C.过程Ⅰ生成无色气体的离子方程式是3Cu+2 +8H+═3Cu2++2NO↑+4H2O +8H+═3Cu2++2NO↑+4H2O |
| D.当活塞不再移动时,再抽入空气,铜可以继续溶解 |
您最近一年使用:0次
2020-12-24更新
|
666次组卷
|
2卷引用:江西省景德镇一中2022-2023学年高一下学期期中考试(18班)化学试题.
名校
解题方法
4 . Ⅰ氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用 NH3将 NOx还原生成N2.某同学在实验室中制备 NH3.回答下列问题:
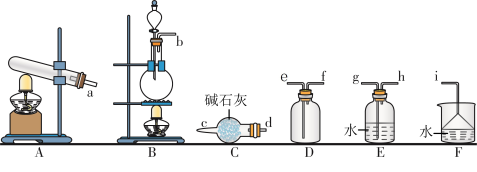
(1)氨气的发生装置可以选择上图中的___________ ,反应的化学方程式为___________ 。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______ →________ →______ →________ →_______ (按气流方向,用小写字母表示 )。
Ⅱ亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应: 2NOCl +H2O = 2HCl + NO↑+NO2↑。某化学兴趣小组设计如图装置用 Cl2和 NO 制备 NOCl。回答下列相关问题:
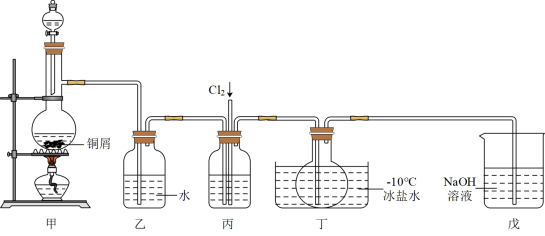
(3)甲装置发生反应的离子方程式为___________ , 装置丙中的液体为___________ 。
(4)实验时,先通入 Cl2,待丁中烧瓶内充满黄绿色气体时,再通入 NO,这样做的目的是___________ 。
(5)装置丁中冰盐水的作用是___________ 。
(6)经分析该套装置设计上有一处明显缺陷,改进方法是___________ (用文字描述)。
(7)吸收尾气时,NOCl 发生反应的化学方程式为___________ 。 (已知:NO+NO2+2NaOH = 2NaNO2+H2O)
(8)反应完成后,取烧瓶中所得产物 mg 溶于水,配制成 250mL 溶液,取出 25.00mL,再加入 VmL cmol/L AgNO3溶液恰好完全反应,则产物中 NOCl 纯度(质量分数)的计算式为___________ 。

(1)氨气的发生装置可以选择上图中的
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→
Ⅱ亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应: 2NOCl +H2O = 2HCl + NO↑+NO2↑。某化学兴趣小组设计如图装置用 Cl2和 NO 制备 NOCl。回答下列相关问题:

(3)甲装置发生反应的离子方程式为
(4)实验时,先通入 Cl2,待丁中烧瓶内充满黄绿色气体时,再通入 NO,这样做的目的是
(5)装置丁中冰盐水的作用是
(6)经分析该套装置设计上有一处明显缺陷,改进方法是
(7)吸收尾气时,NOCl 发生反应的化学方程式为
(8)反应完成后,取烧瓶中所得产物 mg 溶于水,配制成 250mL 溶液,取出 25.00mL,再加入 VmL cmol/L AgNO3溶液恰好完全反应,则产物中 NOCl 纯度(质量分数)的计算式为
您最近一年使用:0次
名校
解题方法
5 . 将1.52g铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(换算为标准状况体积),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
| A.该合金中铜与镁的物质的量之比是1:2 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,N2O4的体积分数是20% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
您最近一年使用:0次
2020-11-28更新
|
327次组卷
|
5卷引用:江西省鹰潭市2019-2020年度高一下学期期末检测化学试题
江西省鹰潭市2019-2020年度高一下学期期末检测化学试题青海湟川中学2020-2021学年高一下学期3月考化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2022年高考化学考点微专题安徽省六安市第一中学2021-2022学年高二上学期开学考试化学试题安徽师范大学附属中学2022-2023学年高二上学期开学考试化学试题
名校
解题方法
6 . 一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是
| A.过量的氢气与氮气 | B.过量的浓盐酸与二氧化锰 |
| C.过量浓硫酸与铜 | D.过量的锌与18 mol/L硫酸 |
您最近一年使用:0次
2020-11-19更新
|
150次组卷
|
2卷引用:江西省南昌县莲塘第三中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
7 . 将44.8g Cu完全溶于适量浓硝酸中,收集到氮的氧化物的混合气体0.8mol,这些气体恰好能被400mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.5mol,则NaOH的浓度为
| A.2mol/L | B.2.4mol/L | C.3mol/L | D.3.6mol/L |
您最近一年使用:0次
2020-11-03更新
|
565次组卷
|
2卷引用:江西省赣州市赣县第三中学2021届高三上学期期中适应性考试化学试题
名校
解题方法
8 . 取一定量的Fe、Cu的混合物粉末,平均分成A、B、C、D、E五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(惟一还原产物)的体积及所得剩余物的质量记录如下(所有体积均在标准状况下测定):
(1)A组实验后17.2 g剩余固体为___________ (均填写化学式)
(2)实验中每次所取混合物中铁的物质的量为________ mol。
(3)若C组金属恰好反应完,则反应后溶液中的金属阳离子为:____ ,物质的量之比是:___ 。
| 实验序号 | A | B | C | D | E |
| 硝酸溶液体积 | 100ml | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72L | 7.84 L | 7.84 L |
(1)A组实验后17.2 g剩余固体为
(2)实验中每次所取混合物中铁的物质的量为
(3)若C组金属恰好反应完,则反应后溶液中的金属阳离子为:
您最近一年使用:0次
名校
解题方法
9 . 氯化亚铜(CuC1)广泛应用于化工、印染、电镀等行业。CuC1难溶于水,可溶于氯离子浓度较大的体系,易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,生产CuC1的工艺如下:
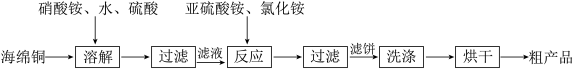
下列说法错误的是

下列说法错误的是
A.“溶解”过程发生氧化还原反应的离子方程式是3Cu+8H++2 =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
B.“反应”过程发生反应的离子方程式是2Cu2++ +2C1-+H2O=2CuC1↓+ +2C1-+H2O=2CuC1↓+ +2H+ +2H+ |
| C.“溶解”过程中硫酸可用浓盐酸代替 |
| D.“烘干”需在隔绝空气的环境中进行 |
您最近一年使用:0次
2020-10-17更新
|
453次组卷
|
3卷引用:江西省丰城市第九中学2021-2022学年高三复读班上学期10月月考化学试题
名校
解题方法
10 . 向l3.6g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入1.0L 0.5 mol/L NaOH溶液,生成沉淀质量为l9.6g,此时溶液呈中性且金属离子已完全沉淀。下列说法正确的是
| A.原固体混合物中Cu与Cu2O的物质的量之比为1:1 |
| B.原稀硝酸中HNO3的物质的量浓度为1.3 mol/L |
| C.产生的NO的体积为2.24L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.lmol |
您最近一年使用:0次
2020-10-15更新
|
744次组卷
|
26卷引用:【全国百强校】江西省新余市第四中学2019届高三7月段考化学试题
【全国百强校】江西省新余市第四中学2019届高三7月段考化学试题2016届全国名校联盟高三联考(二)化学试卷2015-2016学年河北省石家庄一中高二下期末化学试卷全国衡水金卷2018届高三大联考化学试题山西省吕梁市2018届高三上学期第一次阶段性测试化学试题【全国百强校】福建省师范大学附属中学2019届高三上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用(提升练)(已下线)3.3.3 硝酸的性质 人类活动对氮循环和环境的影响练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)安徽省定远县育才学校2021届高三8月月考化学试题黑龙江省哈尔滨市第三中学校2021届高三上学期第二次验收考试化学试题安徽省安庆市宿松县程集中学2021届高三上学期9月月考化学试题福建省福州市福建师范大学附属中学2021届高三上学期期中考试化学试题江苏省苏州市陆慕高级中学2020-2021学年高一下学期3月月考化学试题江苏省启东中学2020-2021学年高一下学期第一次阶段测试化学试题江苏省徐州市邳州市运河中学2020-2021学年高一下学期期中考试(普通班)化学试题辽宁省庄河市高级中学2021-2022学年高二上学期开学考试化学试题云南省澄江市第一中学2021-2022学年高一下学期开学考试化学试题山西省太原师范学院附属中学、太原市师苑中学校2021-2022学年高一下学期3月月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题江苏省无锡市太湖高级中学2022-2023学年高一下学期期中考试化学试题江苏省无锡市名校2022-2023学年高一下学期期中考试化学试题江苏省常州市第一中学2022-2023学年高一下学期期末测试化学试题新疆乌鲁木齐市第101中学2023-2024学年高三上学期8月月考化学试题江苏省扬州中学2023-2024学年高一下学期4月期中考试化学试题江苏省连云港市灌南县两校联考2023-2024学年高一下学期3月月考化学试题福建省福州第八中学2023-2024学年高一下学期期中考试化学试卷



