1 . 回答下列问题
(1)已知 1g 甲烷完全燃烧生成二氧化碳和液态水释放 56kJ 的热量,则甲烷燃烧的热化学方程式___________ 。
(2)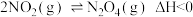 增大压强,平衡
增大压强,平衡___________ 填(“正向移动”“逆向移动”或“不移动”),颜色___________ (填“变深”“变浅”或“不变”)。
(3)工业制备纯硅的反应为 ,若将生成的HCl 通入 100mL1mol·L-1 的 NaOH 溶液中恰好完全反应,则此制备纯硅反应过程中的热效应是
,若将生成的HCl 通入 100mL1mol·L-1 的 NaOH 溶液中恰好完全反应,则此制备纯硅反应过程中的热效应是___________ kJ。
(1)已知 1g 甲烷完全燃烧生成二氧化碳和液态水释放 56kJ 的热量,则甲烷燃烧的热化学方程式
(2)
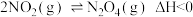 增大压强,平衡
增大压强,平衡(3)工业制备纯硅的反应为
 ,若将生成的HCl 通入 100mL1mol·L-1 的 NaOH 溶液中恰好完全反应,则此制备纯硅反应过程中的热效应是
,若将生成的HCl 通入 100mL1mol·L-1 的 NaOH 溶液中恰好完全反应,则此制备纯硅反应过程中的热效应是
您最近一年使用:0次
解题方法
2 . 完成下列填空
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。
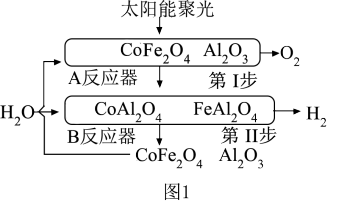
第Ⅰ步:CoFe2O4(s)+3Al2O3(s) CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1
第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g) CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=_______ g·min-1(保留2位小数)。a点时,v正∶v逆=_______ (填最简整数比)。

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=_______ 。
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。

第Ⅰ步:CoFe2O4(s)+3Al2O3(s)
 CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g)
 CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)
 CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=
您最近一年使用:0次
解题方法
3 . 硫酸是重要化工原料之一,研究人员对其生产开展研究。请回答:
(1)工业上一般采用硫铁矿或硫黄粉为原料制备硫酸。
① ,
, 下,下列反应
下,下列反应


则反应 能自发进行的条件是
能自发进行的条件是_______ 。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)_______ 。
A.在制备 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在 转化为
转化为 阶段,控制温度在
阶段,控制温度在 左右的主要原因是为了提高反应速率和平衡转化率
左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: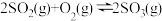
①不同温度下,具有一定能量的分子百分数与分子能量的关系如图所示,E表示 温度下分子的平均能量,
温度下分子的平均能量, 是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
_______  (填“>”、“=”或“<”)。若
(填“>”、“=”或“<”)。若 温度下使用催化剂,请在图中画出相应的变化:
温度下使用催化剂,请在图中画出相应的变化:_______ 。

②某温度下,假设进入接触室内 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少
的物质的量比为1∶1,反应达到平衡时压强减少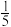 ;保持温度不变,欲使
;保持温度不变,欲使 的平衡转化率提高到90%,则开始时加入
的平衡转化率提高到90%,则开始时加入 和
和 的物质的量比为应为
的物质的量比为应为_______ (计算结果保留1位小数)。
③ 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:_______ 。
步骤Ⅲ:
(3) 的平衡转化率与反应温度和压强的关系如下图。
的平衡转化率与反应温度和压强的关系如下图。

①实际生产选择图中A点的反应条件,不选择B、C点的理由分别是_______ 。
②将组成(物质的量分数)为 和
和 的气体通入反应器,在温度t、压强p条件下进行反应:
的气体通入反应器,在温度t、压强p条件下进行反应: 。平衡时,若
。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)(用含 的代数式表示)。
的代数式表示)。
(1)工业上一般采用硫铁矿或硫黄粉为原料制备硫酸。
①
 ,
, 下,下列反应
下,下列反应

则反应
 能自发进行的条件是
能自发进行的条件是②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)
A.在制备
 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多B.两种方法产生的气体都不需要干燥
C.在
 转化为
转化为 阶段,控制温度在
阶段,控制温度在 左右的主要原因是为了提高反应速率和平衡转化率
左右的主要原因是为了提高反应速率和平衡转化率D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: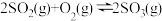
①不同温度下,具有一定能量的分子百分数与分子能量的关系如图所示,E表示
 温度下分子的平均能量,
温度下分子的平均能量, 是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
 (填“>”、“=”或“<”)。若
(填“>”、“=”或“<”)。若 温度下使用催化剂,请在图中画出相应的变化:
温度下使用催化剂,请在图中画出相应的变化:
②某温度下,假设进入接触室内
 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少
的物质的量比为1∶1,反应达到平衡时压强减少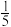 ;保持温度不变,欲使
;保持温度不变,欲使 的平衡转化率提高到90%,则开始时加入
的平衡转化率提高到90%,则开始时加入 和
和 的物质的量比为应为
的物质的量比为应为③
 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:步骤Ⅰ:

步骤Ⅱ:
步骤Ⅲ:

(3)
 的平衡转化率与反应温度和压强的关系如下图。
的平衡转化率与反应温度和压强的关系如下图。
①实际生产选择图中A点的反应条件,不选择B、C点的理由分别是
②将组成(物质的量分数)为
 和
和 的气体通入反应器,在温度t、压强p条件下进行反应:
的气体通入反应器,在温度t、压强p条件下进行反应: 。平衡时,若
。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
4 . 在容积为2L的密闭容器中进行反应:A(g)+2B(g)⇌3C(g)+nD(g)。开始时A的物质的量为4mol,B的物质的量为6mol;5min末到达平衡状态,此时测得C的物质的量为3mol,反应前后压强之比为5:6。
(1)5min末A的物质的量浓度为_______ 。
(2)前5min内用B表示的化学反应速率v(B)为_______ 。
(3)化学方程式中n的值为_______ 。
(4)若10min后继续往容器中加入3molA和C,此时V正_______ V逆(填“>”、“<”或“=”),理由是________
(1)5min末A的物质的量浓度为
(2)前5min内用B表示的化学反应速率v(B)为
(3)化学方程式中n的值为
(4)若10min后继续往容器中加入3molA和C,此时V正
您最近一年使用:0次
2022-06-22更新
|
393次组卷
|
2卷引用:浙江省宁波效实中学2021-2022学年高一下学期期中考试化学(选考)试题
5 . 将3.84g铜与200mL一定浓度的稀硝酸反应,5min时铜恰好完全溶解,产生无色气体NO。待产生的气体全部释放后,向溶液中加入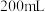
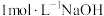 溶液,恰好使溶液中
溶液,恰好使溶液中 全部转化为沉淀。假设溶液体积不变,请计算:
全部转化为沉淀。假设溶液体积不变,请计算:
(1)Cu与稀硝酸反应时,参加反应的硝酸与被还原的硝酸物质的量之比是_______ 。
(2)用硝酸表示前5min内反应的平均速率为_______ 。
(3)原稀硝酸的物质的量浓度是_______  。
。
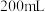
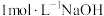 溶液,恰好使溶液中
溶液,恰好使溶液中 全部转化为沉淀。假设溶液体积不变,请计算:
全部转化为沉淀。假设溶液体积不变,请计算:(1)Cu与稀硝酸反应时,参加反应的硝酸与被还原的硝酸物质的量之比是
(2)用硝酸表示前5min内反应的平均速率为
(3)原稀硝酸的物质的量浓度是
 。
。
您最近一年使用:0次
解题方法
6 . 一定条件下,向容积为4 L的密闭容器中通入4 mol SO2和a mol O2发生如下反应:2SO2+O2 2SO3,经过5 min反应达到平衡,SO3的浓度为0.9 mol·Lˉ1,容器内的压强变为原来的80%。请回答:
2SO3,经过5 min反应达到平衡,SO3的浓度为0.9 mol·Lˉ1,容器内的压强变为原来的80%。请回答:
(1)平衡时SO2的浓度____ mol·L-1。
(2)a=____ 。
 2SO3,经过5 min反应达到平衡,SO3的浓度为0.9 mol·Lˉ1,容器内的压强变为原来的80%。请回答:
2SO3,经过5 min反应达到平衡,SO3的浓度为0.9 mol·Lˉ1,容器内的压强变为原来的80%。请回答:(1)平衡时SO2的浓度
(2)a=
您最近一年使用:0次
20-21高一下·安徽合肥·期末
解题方法
7 . 氮元素的单质及其化合物是化学研究的热点。回答下列问题:
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为_______ 。
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为_______ L(标准状况下)。
(2)一定温度时,在体积为2 L的恒容反应器中发生反应: ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
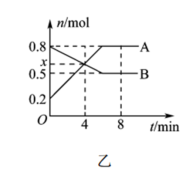
①A为_______ (填化学式)。
②4 min时,v正_______ (填“>”“<”或“=”) v逆。
③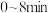 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)=_______ (保留两位有效数字) 。
。
④
_______ ,反应进行4 min时,N2的转化率为_______  。
。
(1)肼(N2H4,常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为
(2)一定温度时,在体积为2 L的恒容反应器中发生反应:
 ,A、B物质的量随时间的变化曲线如图乙所示。
,A、B物质的量随时间的变化曲线如图乙所示。
①A为
②4 min时,v正
③
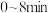 内该反应的平均反应速率v(H2)=
内该反应的平均反应速率v(H2)= 。
。④

 。
。
您最近一年使用:0次
2021-07-17更新
|
702次组卷
|
4卷引用:高中化学-高一下-15
8 . 将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) =xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
(1)反应开始前容器中的A、B的物质的量:n(A)=n(B)=_______ mol。
(2)B的平均反应速率v(B)=_______ mol·L-1·min-1。
(3)x的值为_______ 。
(1)反应开始前容器中的A、B的物质的量:n(A)=n(B)=
(2)B的平均反应速率v(B)=
(3)x的值为
您最近一年使用:0次
20-21高一下·浙江·阶段练习
9 . (1)在一 定温度下,10L密闭容器中加入5.0molSO2、 4.5molO2, 经20min后反应达平衡,此时O2的浓度为0.30mol/L。请计算:
①20min内SO2的化学反应速率___________ ;
②20min 内SO2的转化率___________ ;
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g 某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度___________
②计算并确定此种硬铝的化学式___________ 。
①20min内SO2的化学反应速率
②20min 内SO2的转化率
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g 某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度
②计算并确定此种硬铝的化学式
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
10 . 在1L真空密闭容器中加入a mol PH4I固体,t℃ 时发生如下反应:
PH4I (s)⇌PH3(g) + HI (g) ①
4PH3(g)⇌P4(g)+ 6H2(g) ②
2HI (g)⇌H2(g)+I2(g) ③
达到平衡时,体系中n(HI)=b mol,n(I2)=c mol, n(H2)=d mol,则t℃时反应①的平衡常数K值为_______
PH4I (s)⇌PH3(g) + HI (g) ①
4PH3(g)⇌P4(g)+ 6H2(g) ②
2HI (g)⇌H2(g)+I2(g) ③
达到平衡时,体系中n(HI)=b mol,n(I2)=c mol, n(H2)=d mol,则t℃时反应①的平衡常数K值为
您最近一年使用:0次
2021-05-22更新
|
432次组卷
|
7卷引用:考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专项特训3 多平衡体系的综合分析(已下线)题型25 多反应体系中的化学平衡(已下线)热点题型训练 多重平衡体系中平衡的移动



