(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g)△H1
C2H4(g)+H2O(g)+CO(g)△H1Ⅱ.C2H6(g)+2CO2(g)
 4CO(g)+3H2(g)△H2=+430kJ·mol-1
4CO(g)+3H2(g)△H2=+430kJ·mol-1反应的能量变化图如图所示:
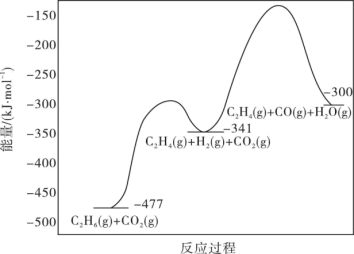
①C2H6(g)+2CO(g)+3H2(g)
 2C2H4(g)+2H2O(g)△H=
2C2H4(g)+2H2O(g)△H=②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)
 C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: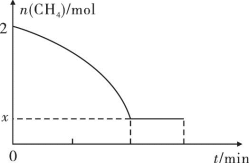
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应:2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H=-127.8kJ/mol,测得相关数据如下:
| 时间 浓度 | 0min | 5min | 10min | 15min | 20min |
| c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②下列表述能说明该反应已达到平衡状态的是
A.CO的化学反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂Ni的羰化反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g)△H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
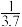 。则:
。则:①0~10min内平均反应速率v(Ni)=
②研究表明,正反应速率v正=k正•x4(CO),逆反应速率v逆=k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的
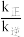 =
=(3)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH
已知:反应1:CH4(g)=C(s)+2H2(g)ΔH1=+75kJ/mol
反应2:2CO(g)=C(s)+CO2(g)ΔH2=-172kJ/mol则该催化反应的ΔH=
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子H将碱性溶液中的NO
 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。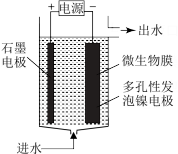
①写出活性原子与NO
 反应的离子方程式
反应的离子方程式②若阳极生成标准状况下2.24L气体,理论上可除去NO
 的物质的量为
的物质的量为 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
4 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家GethardErtl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:

下列说法正确的是
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)关于合成氨工艺的理解,下列错误的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10MPa一30MPa的高压,是因常压下N2和H2的转化率不高
D.将合成后混合气体中的氨液化,剩余气体可以循环利用
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数[φ(NH3)]。

①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)
②在250℃、1.0×104kPa下,N2的转化率为
(4)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因
(5)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol•min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是
②温度为T,在一体积固定的密闭容器中加入2molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
(1)反应:N2(g)+O2(g)⇌2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H2
已知CO的燃烧热为283.0 kJ·mol-1,则△H2=
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的的平均速率为
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
(1)氧化还原法消除NOx的转化如下:
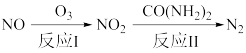
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。
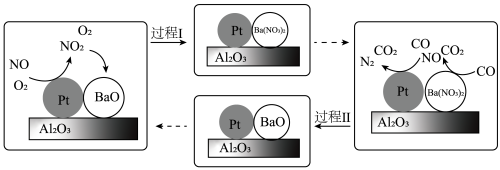
①BaO吸收NO2的化学方程式是
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。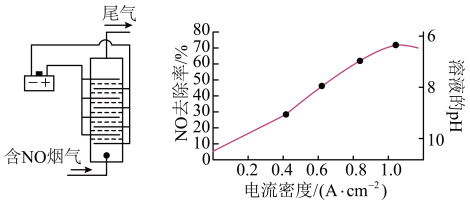
①NO被阳极产生的氧化性物质氧化为
 反应的离子方程式为
反应的离子方程式为②溶液的pH对NO去除率影响的原因是
 、NH
、NH 、SO
、SO 、Mg2+、Al3+、K+、SO
、Mg2+、Al3+、K+、SO 、Cl-、NO
、Cl-、NO 中的一种或几种,已知所含离子的物质的量浓度相等。取甲、乙两支试管分别加入1mL该溶液进行如下实验:①向甲中加入适量稀盐酸,无明显现象;②向乙中逐滴滴加NaOH溶液至过量并加热,现象为先有白色沉淀产生,进而产生刺激性气味气体,最后白色沉淀完全溶解。对于该溶液中的离子成分,下列说法正确的是( )
中的一种或几种,已知所含离子的物质的量浓度相等。取甲、乙两支试管分别加入1mL该溶液进行如下实验:①向甲中加入适量稀盐酸,无明显现象;②向乙中逐滴滴加NaOH溶液至过量并加热,现象为先有白色沉淀产生,进而产生刺激性气味气体,最后白色沉淀完全溶解。对于该溶液中的离子成分,下列说法正确的是( )A.一定含有NH 、Al3+、SO 、Al3+、SO 、Cl-、NO 、Cl-、NO |
B.一定不含CrO 、SO 、SO 、Mg2+、NO 、Mg2+、NO |
C.可能含有Mg2+、K+、Cl-、NO |
D.一定不含CrO 、SO 、SO 、Mg2+、SO 、Mg2+、SO |
 CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:①H2O+*
 H2O* ②H2O*+*
H2O* ②H2O*+* OH*+H*③OH*+*
OH*+H*③OH*+* O*+H* ④2H*+*
O*+H* ④2H*+* H2+2*
H2+2*⑤CO+*
 CO*⑥CO*+O*
CO*⑥CO*+O* CO2*+* ⑦CO2*
CO2*+* ⑦CO2* CO2+*
CO2+*其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)

注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=
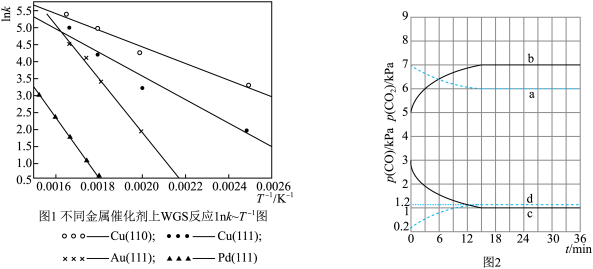
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图象。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是
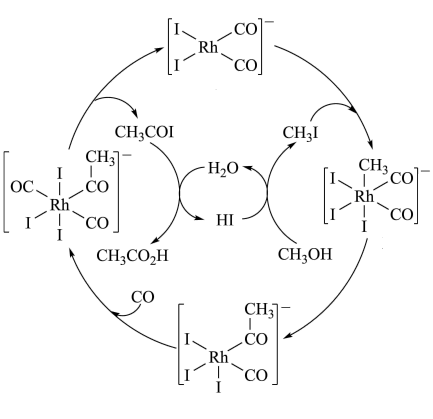
| A.CH3COI是反应中间体 |
| B.甲醇羰基化反应为CH3OH+CO=CH3CO2H |
| C.反应过程中Rh的成键数目保持不变 |
| D.存在反应CH3OH+HI=CH3I+H2O |
请回答下列问题:
I.乙烷蒸汽裂解技术是工业上应用成熟的乙烯制备方法:C2H6(g)
 C2H4(g)+H2(g) △H。
C2H4(g)+H2(g) △H。(1)已知:C2H6(g)、H2(g)和CH2CH2(g)的标准燃烧热分别是1560kJ·mol-1、285.8kJ·mol-1和1411.0kJ·mol-1,则△H=
(2)1000℃时,在某刚性密闭容器内充入一定量的C2H6(g),只发生反应C2H6(g)
 CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=
CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=A.升高温度 B.通入惰性气体
C.增加乙烷浓度 D.加入催化剂
II.乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g)△H=-149kJ·mol-1。
C2H4(g)+H2O(g)△H=-149kJ·mol-1。(3)在乙烷氧化过程中,若
 过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中
过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中 的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示: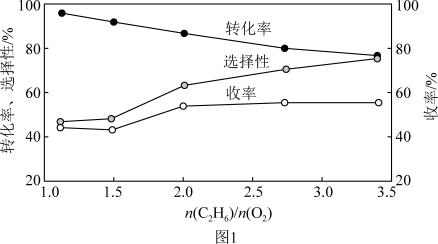
①n
 的最佳比值应为
的最佳比值应为②
 较低时,生成乙烯的选择性较低的原因可能为
较低时,生成乙烯的选择性较低的原因可能为Ⅲ.我国科学家利用固体氧化物电解池成功实现了乙烷电化学脱氢制备乙烯,装置如图2所示:
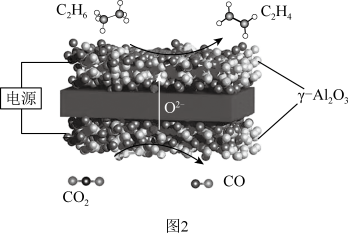
(4)通入CO2的电极为



