1 . 1909年德国化学家哈伯在实验室首次合成氨,合成氨技术的创立开辟了人工固氮的重要途径,其研究正是基于科学化学反应原理的指导。
(1)已知298K时,N2(g)+3H2(g) 2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应
2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应___ (填“能”或“不能”)自发进行。
(2)目前处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
已知:N2(g)+ 3H2(g) 2NH3(g) ΔH1=﹣92.4kJ/mol
2NH3(g) ΔH1=﹣92.4kJ/mol
2H2(g)+ O2(g) 2H2O(l) ΔH2=﹣571.6kJ/mol
2H2O(l) ΔH2=﹣571.6kJ/mol
2N2(g)+ 6H2O(l) 4NH3(g)+3O2(g) ΔH3
4NH3(g)+3O2(g) ΔH3
则ΔH3=___ kJ/mol。
(3)合成氨反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

①t4时刻,体系中是什么条件发生了变化?t4____ 。
②下列时间段中,氨的百分含量最高的是____ 。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
(4)在容积为1L的密闭装置中,充入4mol合成气(N2、H2),在400℃时反应,N2的体积分数随时间变化关系如图所示。

①N2、H2的投料比为____ 。
②反应达到平衡后,测得装置中H2的体积分数为25%,则400℃时,合成氨反应的平衡常数为___ (可用分数表示)。
③在恒温恒容下,N2、H2、NH3的投料为1.5mol、0.5mol、1mol,平衡时H2的体积分数为___ 。
(1)已知298K时,N2(g)+3H2(g)
 2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应
2NH3(g),ΔH=–92.2kJ/mol,ΔS=–198.2J/(K·mol),则根据反应进行的方向综合判据,常温下合成氨反应(2)目前处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
已知:N2(g)+ 3H2(g)
 2NH3(g) ΔH1=﹣92.4kJ/mol
2NH3(g) ΔH1=﹣92.4kJ/mol2H2(g)+ O2(g)
 2H2O(l) ΔH2=﹣571.6kJ/mol
2H2O(l) ΔH2=﹣571.6kJ/mol2N2(g)+ 6H2O(l)
 4NH3(g)+3O2(g) ΔH3
4NH3(g)+3O2(g) ΔH3则ΔH3=
(3)合成氨反应在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。

①t4时刻,体系中是什么条件发生了变化?t4
②下列时间段中,氨的百分含量最高的是
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
(4)在容积为1L的密闭装置中,充入4mol合成气(N2、H2),在400℃时反应,N2的体积分数随时间变化关系如图所示。

①N2、H2的投料比为
②反应达到平衡后,测得装置中H2的体积分数为25%,则400℃时,合成氨反应的平衡常数为
③在恒温恒容下,N2、H2、NH3的投料为1.5mol、0.5mol、1mol,平衡时H2的体积分数为
您最近一年使用:0次
2 . Ⅰ.当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。 CH3OH在酸性介质中的电极反应式为__________________________ 。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________ 。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式__________________________
Ⅱ.(1)Na2CO3溶液去油污的原因:_____________________ 。(用化学用语表示)
(2)已知部分弱酸的电离平衡常数如下表:
则该温度下CH3COONa的pH_______ (填‘大于’、‘等于’或‘小于’)NaHCO3的pH。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________ (填“酸性”“中性”或“碱性”)。
(4)0.1mol/L NH4 Cl溶液中, c(NH4+)+c(NH3•H2O) =________ mol/L 。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。 CH3OH在酸性介质中的电极反应式为
(2)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式
Ⅱ.(1)Na2CO3溶液去油污的原因:
(2)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | CH3COOH | H2CO3 |
| 25℃ | K=1.77×10﹣4 | K1=4.3×10﹣7 K2=5.6×10﹣11 |
则该温度下CH3COONa的pH
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)0.1mol/L NH4 Cl溶液中, c(NH4+)+c(NH3•H2O) =
您最近一年使用:0次
3 . 二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g) CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3
(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=___________ kJ·mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)下列有关反应①叙述不正确的是___________
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图象:
i说明CO的转化率随温度升高先增大后减小的原因:______________________ 。
ii.反应②自发进行的条件是______________________ 。
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________ ;可逆反应③的平衡常数K3=___________ 。
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___________ ν(逆),说明原因_________ 。


甲 乙
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为___________________________ 。
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g)
 CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2③2CH3OH(g)
 CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=
(2)下列有关反应①叙述不正确的是
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图象:
i说明CO的转化率随温度升高先增大后减小的原因:
ii.反应②自发进行的条件是
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)


甲 乙
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为
您最近一年使用:0次
名校
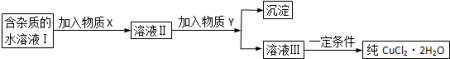
4 . (1)现用氯化铜晶体(CuCl2·2H2O,含少量FeCl2杂质)制取纯净的CuCl2·2H2O,先将其制成水溶液,后按如图步骤进行提纯:
已知:相关物质的溶度积常数见下表:
请回答下列问题:
①请从下列物质中选出第一步中需加入的X( )
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:_____________________________ 。
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是_______ 。(通常认为残留在溶液中的离子浓度小于或等于1×10ˉ5 mol/L时就认为沉淀完全)。
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是___________________________________ 。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属Cd作_______ 极;
②充电时的阳极电极反应式为_____________________________________________ 。
③充电时,当电路中通过0.2moleˉ,阴极质量将_______ (填“增加”、“减少”)___ g。

已知:相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| Ksp | 2.0×10ˉ20 | 1.0×10ˉ38 | 1.64×10ˉ14 |
请回答下列问题:
①请从下列物质中选出第一步中需加入的X
a.NaClO b.H2O2 c.KMnO4 d.HNO3
②溶液Ⅱ中含有少量的Fe3+,如何检验该离子的存在:
③若此时溶液中的c(Cu2+)=0.02mol/L,为得到纯净的CuCl2·2H2O晶体,可加入CuO固体,使溶液中的Fe3+完全转化为Fe(OH)3沉淀且不沉淀Cu2+,调节pH的范围是
④由溶液Ⅲ得到CuCl2·2H2O晶体的操作是
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiO(OH)+H2O
 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2回答下列问题:
①放电时,金属Cd作
②充电时的阳极电极反应式为
③充电时,当电路中通过0.2moleˉ,阴极质量将
您最近一年使用:0次
名校
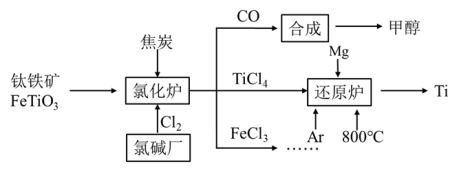
5 . 为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________ ;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为_________________________________________________ 。
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO₃),工业上可也用此反应制备TiO2。请写出该水解方程式__________________________________________ (用TiO2·xH2O或H2TiO₃表示均可),工业上用TiCl4制备TiO2·xH2O时要加入大量的水,同时加热,目的是:______________________________
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是__________________________
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH_____ (填“减小”、“增大”或“不变”)。
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式_____________________________

请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO₃),工业上可也用此反应制备TiO2。请写出该水解方程式
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式
您最近一年使用:0次
名校
6 . 甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是__________ 。
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=__________ mol/L
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式__________ 。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的__________ (填正、负)极,若KOH溶液足量,则写出电池总反应的离子方程式__________ 。
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为__________ ,所得溶液中各种离子的物质的量浓度由大到小的顺序是__________ 。
 CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为
您最近一年使用:0次
名校
7 . 化学与生活生产密切相关。下列说法中,不正确 的是
| A.将海水直接电解可获得 Mg及Cl2等单质 |
| B.把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵 |
| C.施用适量石膏可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
| D.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用 |
您最近一年使用:0次
2018-01-27更新
|
3683次组卷
|
4卷引用:【全国百强校】贵州省铜仁市第一中学2018-2019学年高二下学期开学考试化学试题
8 . 氨是动植物生长不可缺少的元素,氨在自然界中的循环对生命有重要意义。其循环示意图如下:

(1) 氨分子的电子式是__________ 。
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=_______ kJ/mol
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是__________ [填c(NH3·H2O)或c(NH4+)]该温度下NH3·H2O 电离平衡常数为___________ (用a 的代数式表示)。

(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式__________________ 。
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g) 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
该条件下达平衡时H2的转化率α(H2)=______ ,平衡常数K=_________ (用V表示)

(1) 氨分子的电子式是
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是

(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g)
 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:| 时间/min | 0 | 5 | 10 | 20 | 40 | 80 |
| 容器 容积/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
该条件下达平衡时H2的转化率α(H2)=
您最近一年使用:0次
名校
解题方法
9 . 化学反应原理对学习化学有重要的指导作用。某学习小组特邀你参与下列探究:
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
①写出该反应的平衡常数表达式:____________________________ 。
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?_____________ ;
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于_____________ 。
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的_______________ 或者__________________ 。
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?_____________ ;
②写出第三组实验中发生反应的离子方程式_____________ ;
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O
 NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:| 改变条件 | 适当升高温度 | 加水稀释 | 通入HCl(g) | 加少量NaOH固体 |
| 平衡移动方向 | 无需填写 | 正向 | 逆向 | 正向 |
①写出该反应的平衡常数表达式:
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
| 操作 | 现象 | |
| 第一组 | 向2mL1mol/LKI溶液中滴加几滴淀粉溶液 | 未出现蓝色 |
| 第二组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LNaOH溶液再滴加几滴淀粉溶液 | 未出现蓝色 |
| 第三组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LH2SO4溶液再滴加几滴淀粉溶液 | 溶液变蓝 |
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?
②写出第三组实验中发生反应的离子方程式
您最近一年使用:0次
名校
10 . 一篇名为《最终我坐着轮椅被推出了首都国际机场》的文章在网络上引发超过10万次点击。文中女留学在国外吸食笑气导致身体机能全面紊乱,坐轮椅回国。笑气成分是N2O,可作奶油发泡剂,但长期或大剂量滥用会导致神经及脊髓病变。一定条件下,N2O分解的部分实验数据如下表:
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
下图能正确表示该反应有关物理量变化规律的是
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是
A.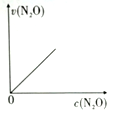 | B.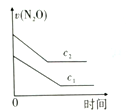 | C. | D.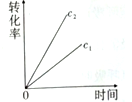 |
您最近一年使用:0次
2017-10-23更新
|
578次组卷
|
4卷引用:贵州省贵阳市第一中学2018届高三上学期适应性月考(二)理科综合化学试题
贵州省贵阳市第一中学2018届高三上学期适应性月考(二)理科综合化学试题河北省衡水市深州市中学2020届高三第一次月考化学试题湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题(已下线)第22讲 化学反应速率(精练)-2021年高考化学一轮复习讲练测



