解题方法
1 . 请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为___________ ,该反应在___________ 条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a =___________ 。
②温度升高后,K值___________ (选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
下列说法正确的是___________ (填字母)
a、若容器内气体密度恒定时,标志反应达到平衡状态
b、甲容器中CO的平衡转化率为60%,大于乙
c、甲、乙容器中,CO的平衡浓度之比为2∶3
d、由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极的电极反应是___________ 。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a =
②温度升高后,K值
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是
a、若容器内气体密度恒定时,标志反应达到平衡状态
b、甲容器中CO的平衡转化率为60%,大于乙
c、甲、乙容器中,CO的平衡浓度之比为2∶3
d、由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极的电极反应是
您最近一年使用:0次
2020-12-26更新
|
140次组卷
|
2卷引用:江西省余干县新时代学校2020-2021学年高二上学期阶段测试(二)化学试题
名校
2 . 雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g) +CO2(g) ΔH=a kJ·mol-1。 在T℃时,反应进行到不同时间测得各物质的浓度如表:
①10~20 min内,NO的平均反应速率v(NO)=_____________ 。
②30 min 后升高温度,再次达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3.则a_____ (填“>”“=”或“<”)0。
③30min后,只改变某一反应条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________ (填字母)。
A.通入一定量的NO
B.加入一定量的活性炭
C.降低温度
(2)NH3催化还原氮氧化物技术(SCR)是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。

已知c(NO2) : c(NO)=1: 1时,脱氮效果最佳。若生成1 mol N2时反应放出的热量为b kJ,此时对应的脱氮反应的热化学方程式为____________ 。
(3)汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag—ZSW一5为催化剂进行反应,测得NO转化为N2的转化率随温度的变化曲线如图所示。

①在 =1时,最佳温度应控制在
=1时,最佳温度应控制在_____ 左右。
②若不使用CO,温度超过775 K时,发现NO的转化率降低,其可能的原因是___ 。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g) +CO2(g) ΔH=a kJ·mol-1。 在T℃时,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①10~20 min内,NO的平均反应速率v(NO)=
②30 min 后升高温度,再次达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3.则a
③30min后,只改变某一反应条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
A.通入一定量的NO
B.加入一定量的活性炭
C.降低温度
(2)NH3催化还原氮氧化物技术(SCR)是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。

已知c(NO2) : c(NO)=1: 1时,脱氮效果最佳。若生成1 mol N2时反应放出的热量为b kJ,此时对应的脱氮反应的热化学方程式为
(3)汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag—ZSW一5为催化剂进行反应,测得NO转化为N2的转化率随温度的变化曲线如图所示。

①在
 =1时,最佳温度应控制在
=1时,最佳温度应控制在②若不使用CO,温度超过775 K时,发现NO的转化率降低,其可能的原因是
您最近一年使用:0次
2020-10-21更新
|
80次组卷
|
2卷引用:贵州省遵义市务川仡佬族苗族自治县汇佳中学2019-2020学年高二上学期期中考试化学试题
3 . 硒(Se)是第四周期VIA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
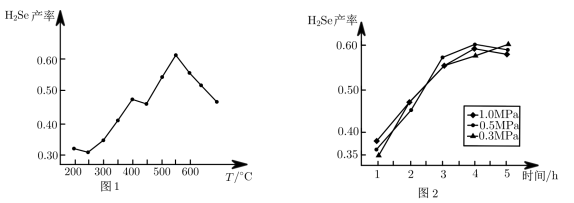
则制备H2Se的最佳温度和压强为_____ 。
(2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=____ (保留2位有效数字)。
(1)T°C时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)⇌H2Se(g)。以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:

则制备H2Se的最佳温度和压强为
(2)由H2Se在一定条件下制备CuSe,已知25℃时CuSe的Ksp=7.9×10-49,CuS的Ksp=l.3×10-36,则反应CuS(s)+Se2-(aq)⇌CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
4 . 甲醛(HCHO)俗称蚁醛,在化工、医药、农药等方面有广泛的应用。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,已知:CH3OH(g) HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H
(1)该反应的能量变化如图甲所示,△H=___ kJ•mol-1。

(2)为提高CH3OH转化率,采取的措施有___ 、___ ;在温恒容条件下,该反应达到平衡状态的标志有___ (填标号)。
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为___ (填标号),理由是___ 。
a.400℃b.650℃c.700℃d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mol甲醇,发生反应:
①CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
②CH3OH(g) CO(g)+2H2(g)
CO(g)+2H2(g)
平衡时甲醇为0.2mol,甲醛为0.7mol。则反应i的平衡常数K=___ 。
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为___ :若收集到112mLCO2(标准状况),理论上转移电子___ mol。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,已知:CH3OH(g)
 HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H(1)该反应的能量变化如图甲所示,△H=

(2)为提高CH3OH转化率,采取的措施有
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为
a.400℃b.650℃c.700℃d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mol甲醇,发生反应:
①CH3OH(g)
 HCHO(g)+H2(g)
HCHO(g)+H2(g)②CH3OH(g)
 CO(g)+2H2(g)
CO(g)+2H2(g)平衡时甲醇为0.2mol,甲醛为0.7mol。则反应i的平衡常数K=
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为
您最近一年使用:0次
2020-04-22更新
|
399次组卷
|
2卷引用:贵州省2020年普通高等学校招生适应性测试理综化学试题
5 . 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=_________ 。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________ ;
②该温度下,CO2的平衡转化率为________ 。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________ 0(填“>”或“<”)。
②曲线c表示的物质为________ 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________ 。(答出一条即可)

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH
②曲线c表示的物质为
③为提高H2的平衡转化率,除改变温度外,还可采取的措施
您最近一年使用:0次
2020-02-19更新
|
366次组卷
|
5卷引用:贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
6 . 国家倡导推进传统产业改造升级,引导企业创新优化产业结构。其根本目的是节能减排,“减排”的关键是减少CO2排放,而“减排”的重要手段是合理利用CO2。回答下列问题:
(1)CO2的电子式是___ 。
(2)利用CO2可合成尿素[CO(NH2)2],合成原料除CO2外,还有NH3。该方法制备尿素的化学方程式是 ,该方法制备尿素一般需
,该方法制备尿素一般需 >2,即NH3过量,原因是
>2,即NH3过量,原因是____ 。
(3)利用太阳能,以CO2为原料制取炭黑的流程如图1所示:一定条件“过程1”生成1mol炭黑的反应热为ΔH1;“过程2”的热化学方程式为:2Fe3O4(s) 6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为
6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为___ 。

(4)将1mol CO2和3mol H2充入容积为1L的恒容密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
①图2是测得的该反应中X、Y的浓度随时间变化的曲线,其中X为___ (写化学式),反应达到平衡时的平均反应速率v(H2)=____ mol·L-1·min-1。

②不同温度下平衡时,混合气体中H2的物质的量随温度的变化曲线如图3所示,则该反应的ΔH____ 0(填“>”“<”或“不能确定”);测定温度小于T2时,反应体系中无O2存在,则T1~T2的温度范围内,H2的物质的量急剧增大的原因可能是____ 。

(5)CO2还可以合成甲醇:CO2(g)+3H2(g) H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=
H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=___ 。

(1)CO2的电子式是
(2)利用CO2可合成尿素[CO(NH2)2],合成原料除CO2外,还有NH3。该方法制备尿素的化学方程式是
 ,该方法制备尿素一般需
,该方法制备尿素一般需 >2,即NH3过量,原因是
>2,即NH3过量,原因是(3)利用太阳能,以CO2为原料制取炭黑的流程如图1所示:一定条件“过程1”生成1mol炭黑的反应热为ΔH1;“过程2”的热化学方程式为:2Fe3O4(s)
 6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为
6FeO(s)+O2(g) ΔH2。则图1中制备炭黑的热化学方程式为
(4)将1mol CO2和3mol H2充入容积为1L的恒容密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。①图2是测得的该反应中X、Y的浓度随时间变化的曲线,其中X为

②不同温度下平衡时,混合气体中H2的物质的量随温度的变化曲线如图3所示,则该反应的ΔH

(5)CO2还可以合成甲醇:CO2(g)+3H2(g)
 H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=
H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1,一定条件下,将1 mol CO2和2.8 mol H2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图4所示。n点的平衡常数K=
您最近一年使用:0次
7 . 氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351 kJ·mol-1
2C(s)+O2(g)=2CO(g);△H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s)△H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____ 。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H4。
CH4(g)+2H2O(g)△H4。
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数 ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。

①A、B、C、D、E五点中,尚未达到平衡的点是___ ,该反应的△H4__ 0(填“>”或“<”)。
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___ ;平衡常数为____

(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
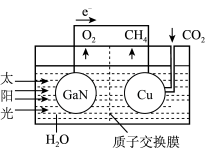
①写山铜电极表面的电极反应式____ 。
②为提高该人工光合系统的工作效率,可向装置中加入少量__ (选填“盐酸”或“硫酸”)。
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351 kJ·mol-1
2C(s)+O2(g)=2CO(g);△H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s)△H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H4。
CH4(g)+2H2O(g)△H4。常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数
 ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
①A、B、C、D、E五点中,尚未达到平衡的点是
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=

(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。

①写山铜电极表面的电极反应式
②为提高该人工光合系统的工作效率,可向装置中加入少量
您最近一年使用:0次
解题方法
8 . “绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g) S(l)+2CO2(g) △H1=-37.4kJ·mol-1
S(l)+2CO2(g) △H1=-37.4kJ·mol-1
b.S(l)+2H2O(g) 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______ 。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g) CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
①前10min内的平均反应速率v(CO)=______ ;在20min时,温度T2下,该反应的化学平衡常数为_______ 。
②若30min时升高温度,化学平衡常数值_______ (填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______ (填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g) CH3OH(g)反应达到平衡状态的
CH3OH(g)反应达到平衡状态的_____ (填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g) 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。

则k1=____ ,m=_____ ,n=_____ 。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)
 S(l)+2CO2(g) △H1=-37.4kJ·mol-1
S(l)+2CO2(g) △H1=-37.4kJ·mol-1b.S(l)+2H2O(g)
 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1则CO和水蒸气完全反应生成H2和CO2的热化学方程式为
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)
 CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:| 反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 4 | 0 |
| 10min | 2 | ||
| 20min | 0.2 |
①前10min内的平均反应速率v(CO)=
②若30min时升高温度,化学平衡常数值
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有
④在恒温恒容下,下列可以判断CO(g)+2H2(g)
 CH3OH(g)反应达到平衡状态的
CH3OH(g)反应达到平衡状态的a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)
 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
则k1=
您最近一年使用:0次
名校
解题方法
9 . 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:____________________________________________ 。
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为_________________________________ 。
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。
①下列措施有利于提高反应物转化率的是___________ (填序号)。
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为_________________________________ 。
③已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-1
1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=________________ 。
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是______________________ 。
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为______________________ 。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g)
 CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。①下列措施有利于提高反应物转化率的是
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为

③已知:CO(g)+
 O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1H2(g)+
 O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-11mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
10 . 下列图示与对应的叙述不相符合的是
A. 表示燃料燃烧反应的能量变化 表示燃料燃烧反应的能量变化 |
B. 表示酶催化反应的反应速率随反应温度的变化 表示酶催化反应的反应速率随反应温度的变化 |
C.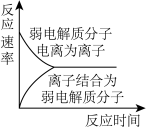 表示弱电解质在水中建立电离平衡的过程 表示弱电解质在水中建立电离平衡的过程 |
D.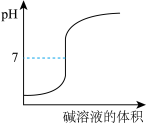 表示强碱滴定强酸的滴定曲线 表示强碱滴定强酸的滴定曲线 |
您最近一年使用:0次
2019-01-30更新
|
1421次组卷
|
46卷引用:贵州省都匀第一中学2019-2020学年高二上学期期中考试化学试题
贵州省都匀第一中学2019-2020学年高二上学期期中考试化学试题2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2017届河北省衡水中学高三上学期摸底考试化学试卷2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届河南省郑州一中高三上期中化学试卷2017届宁夏石嘴山三中高三上期中化学试卷2016-2017学年天津市部分区高二上学期期末化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题云南省玉溪市民族中学2017-2018学年高二上学期期中考试化学试卷河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题鄱阳一中2017-2018学年度上学期高二年级第二次检测化学试卷江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题1山东省德州市2017-2018学年高二上学期期末考试化学试题广东省惠州市2018届高三第三次调研考理科综合化学试题2广东省普宁市华美实验学校2017-2018学年高二下学期第一次月考化学试题福建省晋江市季延中学2017-2018学年高二下学期期末考试化学试题四川省内江铁路中学2019届高三上学期入学考试化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】江苏省启东中学2018-2019学年高一(创新班)下学期3月月考化学试题江苏省苏州市第五中学2018-2019学年高二下学期期中考试化学试题广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题山西省运城市新绛中学2021届高三上学期8月月考化学试题湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题河北省衡水市武强中学2020-2021学年高二上学期第三次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题湖北省宜昌市夷陵中学2021-2022学年高二下学期诊断性检测(二)化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题内蒙古莫力达瓦旗尼尔基第一中学2021-2022学年高三上学期期末考试化学试题山东省德州市德州耀华学校2021-2022学年高二上学期第三次质量调研12月考化学试题浙江省绍兴市柯桥区2022-2023学年高二上学期期末教学质量调测化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题



