名校
解题方法
1 . 氮及其化合物的转化过程如图所示。下列分析合理的是
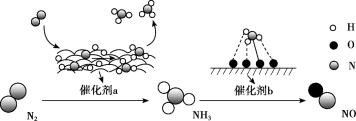

| A.催化剂a表面只发生极性共价键的断裂和形成 |
| B.N2与H2反应生成NH3的原子利用率为100% |
| C.在催化剂b表面形成氮氧键时,不涉及电子转移 |
| D.催化剂a、b能提高反应的平衡转化率 |
您最近一年使用:0次
2021-05-19更新
|
787次组卷
|
23卷引用:天津市南开区2020届高三上学期期末考试化学试题
天津市南开区2020届高三上学期期末考试化学试题【区级联考】北京市朝阳区2019届高三下学期二模考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题辽宁省沈阳市五校协作体2020届高三上学期期中考试化学试题北京市石景山区精华学校2019-2020学年高三上学期二次月考化学试题山东省2020届高三模拟考试化学试题山东省潍坊市昌乐县2020年高三上学期第一次高考模拟化学试题河北省枣强中学2019-2020学年高二下学期第三次月考化学试题北京市房山区2020届高三一模化学试题福建省福州市2019届高三5月高考模拟化学试题山东省2020届普通高中学业水平等级考试 · 模拟卷(三)化学试题新疆吾尔自治区乌鲁木齐市第七十中学2021届高三上学期第一次月考(9月)化学试题安徽省涡阳县第一中学2021届高三上学期第二次月考化学试题湖南省张家界市2020-2021学年高二上学期期末考试化学试题湖南省长沙市宁乡市2020-2021学年高二下学期期末调研考试化学试题福建省莆田第一中学2020-2021学年高二下学期期中考试化学试题天津市西青区张家窝中学2022届高三上学期第一次月考化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)2022年江苏卷高考真题变式题1-13(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题6-10)北京市中国人民大学附属中学朝阳学校2021-2022学年高三上学期第一次月考化学试题陕西省榆林市2023-2024学年高二上学期10月月考化学试题(已下线)物质反应及转化
名校
2 . 下列说法正确的是
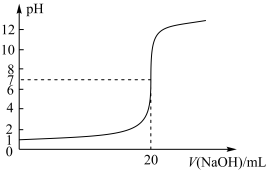

| A.用石墨电极电解熔融 Al2O3时,阳极须定期更换 |
| B.如上图所示为向10 mL一定浓度的HCl溶液中滴加NaOH溶液时,所得室温下溶液pH随NaOH溶液体积的变化,由图可知c(NaOH)=0.1 mol·L−1 |
| C.由方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol−1可知甲烷的燃烧热为890.3 kJ·mol−1 |
D.C(s)+H2O(g)  CO(g)+H2(g)在一定条件下能自发进行的原因是ΔH>0 CO(g)+H2(g)在一定条件下能自发进行的原因是ΔH>0 |
您最近一年使用:0次
2021-03-29更新
|
252次组卷
|
2卷引用:江苏省白蒲高级中学2020-2021学年高二上学期教学质量调研(三)化学试题
解题方法
3 . 下列实验操作和现象正确,且能得到对应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向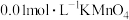 ,酸性溶液中滴加 ,酸性溶液中滴加 溶液,充分振荡 溶液,充分振荡 | 溶液褪色 |  体现氧化性 体现氧化性 |
| B | 向滴有酚酞的 溶液中加入 溶液中加入 溶液 溶液 | 溶液颜色逐渐褪去 |  溶液中的水解平衡发生了移动 溶液中的水解平衡发生了移动 |
| C | 镀锡铁出现刮痕后浸入饱和食盐水中,一段时间后滴入 溶液 溶液 | 有蓝色沉淀 | 铁作原电池正极 |
| D |  | 先产生白色沉淀,后变为黄色沉淀 | 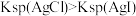 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 二甲醚(CH3OCH3)是重要的能源物质,其制备、应用与转化是研究的热点。
(1)利用合成气制备二甲醚主要包含三个反应:
①CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
③CO(g)+H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=___________ 。
(2)某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A电极名称为___________ ,A电极附近溶液pH___________ (填“减小”“增大”或“不变”);电极B的电极反应式为___________ 。

(3)二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。

①ΔH1___________ (填“>”“<”或“=”)0。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是___________ 。
③600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是___________ 。
④400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有___________ 。
(1)利用合成气制备二甲醚主要包含三个反应:
①CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
③CO(g)+H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=
(2)某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A电极名称为

(3)二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。

①ΔH1
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是
③600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是
④400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有
您最近一年使用:0次
5 . 工业上除去电石渣浆 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:

下列说法正确的是
 含
含 上清液中的
上清液中的 ,并制取石膏
,并制取石膏 的常用流程如下:
的常用流程如下:
下列说法正确的是

A. 、 、 在过程Ⅰ、Ⅱ中均起催化剂作用 在过程Ⅰ、Ⅱ中均起催化剂作用 |
B.过程Ⅰ中,反应的离子方程式为 |
C.将10L上清液中的 转化为 转化为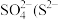 浓度为480 mg·L−1),理论上共需要0.03mol的 浓度为480 mg·L−1),理论上共需要0.03mol的 |
D.常温下,56gCaO溶于水配成1L溶液,溶液中 的数目为 的数目为 个 个 |
您最近一年使用:0次
2021-01-02更新
|
549次组卷
|
5卷引用:江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题
江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题安徽省示范高中皖北协作区2020年第22届高三联考理科综合化学(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)湖北省龙泉中学、宜昌一中2021届高三下学期2月联合考试化学试题黑龙江省大庆实验中学实验一部2020-2021学年高一下学期开学考试化学试题
解题方法
6 . 以废旧磷酸亚铁锂电池正极片( 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。

回答下列问题:
(1) 中Fe元素的化合价为
中Fe元素的化合价为_________ ;“放电处理”有利于锂在正极的回收,其原因是__________ 。
(2)“碱浸”中发生反应的离子方程式为________________________________ 。
(3)“浸取”中加入 的作用为
的作用为________________ ;“沉铁”过程所得滤渣为白色固体,其主要成分是________________ 。
(4)已知碳酸锂的分解温度为 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是________________ ; 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为_____ 。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式_________________________________ 。
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
您最近一年使用:0次
2020-11-24更新
|
565次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题
名校
7 . 某研究小组探究饮用水中铁锰的来源和去除原理。
I.铁锰来源
某地区地下水铁锰含量和国家标准对比
(1)利用FeCO3溶解度计算溶出的Fe2+为1.1mg/L,依据上表数据,结合平衡移动原理,解释地下水中Fe2+含量远大于1.1mg/L的原因_____ 。
II.去除原理

(2)自然氧化法:
①曝气池中使水呈“沸腾”状的作用_____ 。
②补全曝气池中氧化Fe2+时发生反应的离子方程式:
________ Fe2++________ O2+________ H2O=________ Fe(OH)3+________ _____ 。
此方法铁去除时间长,锰去除率低。
(3)药剂氧化法:工业上可以采用强氧化剂(ClO2、液氯、双氧水等),直接氧化Fe2+、Mn2+生成Fe(OH)3和MnO2除去。某实验中pH=6.5时,Fe2+、Mn2+浓度随ClO2投加量的变化曲线如图:
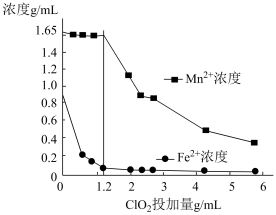
①ClO2投加量小于1.2mg/L时,可以得出Fe2+、Mn2+性质差异的结论是______ 。
②分析图中数据ClO2氧化Mn2+是可逆反应。写出反应的离子方程式______ 。
③写出两种提高锰去除率的方法______ 。
I.铁锰来源
某地区地下水铁锰含量和国家标准对比
| 某些地区地下水常见微粒含量(mg/L) | 国家饮用水标准(mg/L) | |||||
| Fe2+ | Mn2+ | HCO | CO2 | Fe2+ | Mn2+ | pH |
| 4~20 | 0.4~3 | 1~1.5 | 30~70 | 0.3 | 0.1 | 6.5~8.5 |
II.去除原理

(2)自然氧化法:
①曝气池中使水呈“沸腾”状的作用
②补全曝气池中氧化Fe2+时发生反应的离子方程式:
此方法铁去除时间长,锰去除率低。
(3)药剂氧化法:工业上可以采用强氧化剂(ClO2、液氯、双氧水等),直接氧化Fe2+、Mn2+生成Fe(OH)3和MnO2除去。某实验中pH=6.5时,Fe2+、Mn2+浓度随ClO2投加量的变化曲线如图:

①ClO2投加量小于1.2mg/L时,可以得出Fe2+、Mn2+性质差异的结论是
②分析图中数据ClO2氧化Mn2+是可逆反应。写出反应的离子方程式
③写出两种提高锰去除率的方法
您最近一年使用:0次
2020-11-09更新
|
307次组卷
|
3卷引用:北京市丰台区 2020-2021 学年高三上学期期中考试化学试题
名校
解题方法
8 . 氮及其化合物的转化过程如图所示。下列分析合理的是( )


| A.催化剂a、b能提高反应的平衡转化率 |
| B.在催化剂b表面形成氮氧键时不涉及电子转移 |
| C.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成 |
| D.如果向容器中放入1molN2和3molH2,最终可以生成2molNH3 |
您最近一年使用:0次
2020-11-09更新
|
375次组卷
|
5卷引用:北京市丰台区 2020-2021 学年高三上学期期中考试化学试题
名校
解题方法
9 . 电化学原理在工业生产中发挥着巨大的作用。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为_______
②阴极产生的气体为________
③右侧的离子交换膜为________ (填“阴”或“阳”)离子交换膜,阴极区a%_______ b%(填“>”“=”或“<”)
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH )
)_________ (填“>”“<”或“=”)c(NO )。
)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为_______ 。
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是______ g。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为
②阴极产生的气体为
③右侧的离子交换膜为
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH
 )
) )。
)。②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是
您最近一年使用:0次
2020-10-18更新
|
1014次组卷
|
2卷引用:山东省实验中学2021届高三上学期第一次诊断考试化学试题
解题方法
10 . Cu2O是重要的化工原料,主要用于制造船底防污漆、杀虫剂等。回答下列问题:
(1)氧化亚铜制备
①用CuO与Cu在900℃高温烧结可得Cu2O。
已知:2Cu(s)+O2(g)=2CuO(s) △H1=-314kJ•mol-1
2Cu2O(s)+O2(g)=4CuO(s) △H2=-292kJ•mol-1
则反应CuO(s)+Cu(s)=Cu2O(s)的△H3=___ kJ•mol-1。
②肼还原制备Cu2O。方法如下:将3~5mL浓度为20%N2H4(肼)水溶液倒入50mL高浓度醋酸铜水溶液中,使Cu2+被还原,并产生氮气。将生成的Cu2O沉淀用水、乙醇和乙醚洗涤。
生成Cu2O的离子方程式为_____ ;肼不宜过量,可能的原因是___ 。
③电解法制备Cu2O流程如图:

电解时阳极生成Cu2Cl2的电极反应式为____ ,Cu2Cl2在溶液中生成Cu2O的化学方程式为___ 。
(2)Cu2O与ZnO组成的催化剂可用于催化合成甲醇[CO(g)+2H2(g) CH3OH(g)]。将H2和CO按
CH3OH(g)]。将H2和CO按 =2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
=2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:

①随着温度的升高,该反应的平衡常数____ (填“增大”“减小”或“不变”);图中压强由大到小的顺序为____ 。
②提高CO的平衡转化率除温度和压强外,还可采取的措施是___ 。
(1)氧化亚铜制备
①用CuO与Cu在900℃高温烧结可得Cu2O。
已知:2Cu(s)+O2(g)=2CuO(s) △H1=-314kJ•mol-1
2Cu2O(s)+O2(g)=4CuO(s) △H2=-292kJ•mol-1
则反应CuO(s)+Cu(s)=Cu2O(s)的△H3=
②肼还原制备Cu2O。方法如下:将3~5mL浓度为20%N2H4(肼)水溶液倒入50mL高浓度醋酸铜水溶液中,使Cu2+被还原,并产生氮气。将生成的Cu2O沉淀用水、乙醇和乙醚洗涤。
生成Cu2O的离子方程式为
③电解法制备Cu2O流程如图:

电解时阳极生成Cu2Cl2的电极反应式为
(2)Cu2O与ZnO组成的催化剂可用于催化合成甲醇[CO(g)+2H2(g)
 CH3OH(g)]。将H2和CO按
CH3OH(g)]。将H2和CO按 =2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
=2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
①随着温度的升高,该反应的平衡常数
②提高CO的平衡转化率除温度和压强外,还可采取的措施是
您最近一年使用:0次



