名校
1 . 判断正误
(1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。___
(2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。___
(3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。___
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。____
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。____
(6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。____
(7)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。_____
(8)同主族元素的简单阴离子还原性越强,水解程度越大。___
(9)已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。____
(10)Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。____
(1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。
(2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。
(3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。
(6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。
(7)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。
(8)同主族元素的简单阴离子还原性越强,水解程度越大。
(9)已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。
(10)Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。
您最近一年使用:0次
2018-01-21更新
|
90次组卷
|
2卷引用:贵州省思南中学2017-2018学年高二上学期期末考试化学试题
解题方法
2 . 下列关于无机物应用的叙述正确的是( )
A. 湿法脱除烟气中的NO,是利用 湿法脱除烟气中的NO,是利用 的氧化性 的氧化性 |
B.半导体工业中可用氢氟酸除去硅片表面的 层,是因为HF具有强酸性 层,是因为HF具有强酸性 |
C. 法利用 法利用 溶液脱除烟气中的 溶液脱除烟气中的 ,是利用 ,是利用 溶液呈酸性 溶液呈酸性 |
D.用氨水除去铜器表面的 转化为 转化为 ,是利用 ,是利用 的还原性 的还原性 |
您最近一年使用:0次
2020-01-26更新
|
105次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——氨气性质和应用
名校
解题方法
3 . 碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
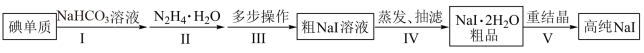
已知:
①I2(s)+I-(aq) I
I (aq)。
(aq)。
②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__ 。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__ 。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__ 。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__ 。
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__ 。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__ 。
(5)将制备的NaI•2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__ 。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI•2H2O粗品溶解 ③趁热过滤 ④真空干燥
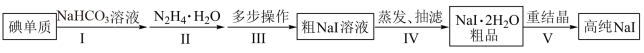
已知:
①I2(s)+I-(aq)
 I
I (aq)。
(aq)。②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO
 离子。
离子。①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为
②实验过程中,加少量NaI固体能使反应速率加快,其原因是
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为
(5)将制备的NaI•2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI•2H2O粗品溶解 ③趁热过滤 ④真空干燥
您最近一年使用:0次
2020-07-10更新
|
307次组卷
|
4卷引用:浙江省温州市2020年4月份普通高中选考适应性测试(二模)化学试题
4 . (1)白色固体PCl5受热即挥发并发生分解:PCl5(g)  PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________ 。
(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO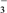 >I-,氧化性IO
>I-,氧化性IO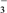 >I2>SO
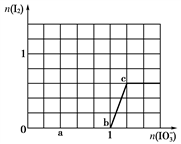
>I2>SO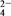 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________ mol。
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:_____________________ ,该过程中被氧化的元素是 ___________ ,当产生标准状况下2.24L 时,共转移电子
时,共转移电子_______ mol。
 PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO
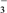 >I-,氧化性IO
>I-,氧化性IO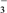 >I2>SO
>I2>SO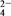 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:
 时,共转移电子
时,共转移电子
您最近一年使用:0次
10-11高三下·上海静安·阶段练习
名校
解题方法
5 . 已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
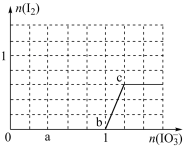
(1)写出a点反应的离子方程式__________________________ ;反应中还原剂是________ ;被还原的元素是________ 。
(2)写出b点到c点反应的离子方程式__________________________________________ 。
(3)当溶液中的I-为0.4 mol时,加入的KIO3为____________ mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为_____________ 。

(1)写出a点反应的离子方程式
(2)写出b点到c点反应的离子方程式
(3)当溶液中的I-为0.4 mol时,加入的KIO3为
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
您最近一年使用:0次
11-12高二上·甘肃兰州·期末
6 . 坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种。下列关于铁的说法中正确的是
| A.铁单质只具有还原性,其阳离子只具有氧化性 |
| B.常温下,单质铁与浓硫酸不反应 |
| C.铁元素属于过渡元素,其原子序数为26 |
| D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快 |
您最近一年使用:0次
名校
解题方法
7 . 某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计左下图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如右下图,下列有关叙述错误的是
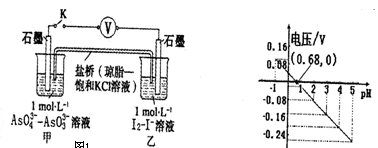

| A.pH>0.68时,甲烧杯中石墨为负极 |
| B.pH=0.68时,反应处于平衡状态 |
| C.pH>0.68时,氧化性I2>AsO43- |
| D.pH=5时,负极电极反应式为2I--2e-=I2 |
您最近一年使用:0次
解题方法
8 . 分乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值。
Ⅰ.乙醇可以作为燃料燃烧。
(1)已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量。应用表中数据(25℃、101 kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式_____ 。
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(2)三种乙醇燃料电池中正极反应物均为_______ 。
(3)碱性乙醇燃料电池中,电极a上发生的电极反应式为_______ ,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_________ 。
(4)酸性乙醇燃料电池中,电极b上发生的电极反应式为______ ,通过质子交换膜的离子是_________ 。
(5)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO 向电极
向电极_________ (填“a”或“b”)移动,电极b上发生的电极反应式为_____ 。
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g) + C2H4(g) CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如图:
CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如图:

(6)图中压强P1、P2、P3、P4的大小顺序为:_________ ,理由是:_________ 。
(7)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。该条件下乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________ 、_________ 。
Ⅳ.探究乙醇与溴水是否反应。
(8)探究乙醇与溴水在一定条件下是否可以发生反应,实验如下:
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是_________ 。
②实验3的作用是_________ 。
③根据实验现象得出的结论是_________ 。
(9)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应_________ (已知若发生氧化反应,则Br2全部转化为HBr)。
Ⅰ.乙醇可以作为燃料燃烧。
(1)已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量。应用表中数据(25℃、101 kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式
| 键 | C—C | C—H | O=O | H—O | C—O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(2)三种乙醇燃料电池中正极反应物均为
(3)碱性乙醇燃料电池中,电极a上发生的电极反应式为
(4)酸性乙醇燃料电池中,电极b上发生的电极反应式为
(5)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO
 向电极
向电极Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g) + C2H4(g)
 CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如图:
CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如图:
(6)图中压强P1、P2、P3、P4的大小顺序为:
(7)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。该条件下乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有
Ⅳ.探究乙醇与溴水是否反应。
(8)探究乙醇与溴水在一定条件下是否可以发生反应,实验如下:
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是
②实验3的作用是
③根据实验现象得出的结论是
(9)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应
您最近一年使用:0次
9 . 根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________ ,乙中的反应:_____________________ 。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________ ,丁装置的目的是________________________ ;干燥管Ⅱ的作用是______________________ 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____ (填“偏高”或“偏低”),简述可能的原因:______________________ 。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________ 。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是
您最近一年使用:0次
2020-04-19更新
|
292次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2019-2020学年高二下学期期末考试化学试题
10 . 如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____ (填“正极”或“负极”),通氢气一极的电极反应式为_________________ ;
(2)铁电极为_______ (填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________ 。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______ g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
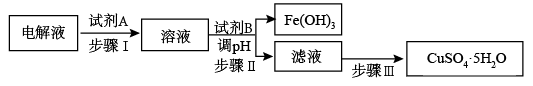
已知:几种金属阳离子开始沉淀和沉淀完全的pH:
①步骤I中加入试剂A的目的是_____________________________ ,试剂A应选择______ (填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________ ;
②步骤II中试剂B为_________ ,调节pH的范围是___________ ;
③步骤III的操作是加热浓缩、_______ 、___________ 。

(1)通入氧气的电极为
(2)铁电极为
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因
②步骤II中试剂B为
③步骤III的操作是加热浓缩、
您最近一年使用:0次
2018-01-27更新
|
690次组卷
|
4卷引用:河北省张家口市2017-2018学年高二上学期期末考试化学试题



