1 . 磷元素有白磷、红磷等单质,白磷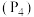 结构及晶胞如图所示,白磷和红磷转化的热化学方程式为
结构及晶胞如图所示,白磷和红磷转化的热化学方程式为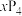 (白磷,s)
(白磷,s)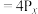 (红磷,s)
(红磷,s)  。下列说法正确的是
。下列说法正确的是
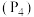 结构及晶胞如图所示,白磷和红磷转化的热化学方程式为
结构及晶胞如图所示,白磷和红磷转化的热化学方程式为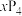 (白磷,s)
(白磷,s)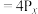 (红磷,s)
(红磷,s)  。下列说法正确的是
。下列说法正确的是
A. 属于共价晶体 属于共价晶体 |
B.白磷中的P—P—P夹角为 |
C.白磷晶胞中,P—P键的作用弱于 的分子间作用力 的分子间作用力 |
D.白磷(s)和红磷(s)在 中充分燃烧生成等量 中充分燃烧生成等量 ,白磷放出的热量更多 ,白磷放出的热量更多 |
您最近一年使用:0次
名校
解题方法
2 . 氢气作为一种清洁能源,一直是能源研究的热点,水煤气变换反应可用于大规模制 ,反应原理如下:
,反应原理如下:
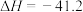 kJ⋅mol
kJ⋅mol
(1)根据下表中提供的数据,计算

 。
。化学键 |
|
|
|
|
键能/kJ·mol | 803 | x | 463 | 436 |
(2)某温度下,在一恒容密闭容器中充入CO和
 ,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为
,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为 ,分压如图甲所示(t时刻前,
,分压如图甲所示(t时刻前, 的分压未给出),则A点坐标为(t,
的分压未给出),则A点坐标为(t,
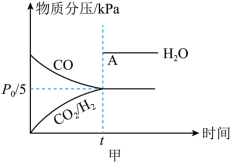
(3)反应
 的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为
的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为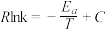 (其中
(其中 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能
当使用更高效催化剂时,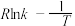
您最近一年使用:0次
3 . 请根据学过的知识回答下列问题:
(1)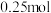
 完全燃烧生成液态水时放出341.7kJ热量,则表示
完全燃烧生成液态水时放出341.7kJ热量,则表示 燃烧热的热化学方程
燃烧热的热化学方程___________ 。
(2)已知: 键的键能是
键的键能是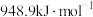 ,
, 键的键能是
键的键能是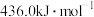 ,
, 键的键能是
键的键能是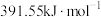 ,则
,则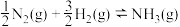

___________ 。
(3)已知:①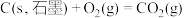
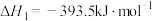
②

③

则298K时反应 的焓变:
的焓变:
___________ 。
(4)已知常温时红磷比白磷稳定,比较下列反应中 的大小:
的大小:
___________  。
。
①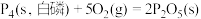

②

(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和
 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为___________ 。
(6)如图所示,某反应在不同条件下的反应历程分别为a、b。
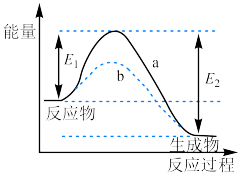
据图可判断出反应物的总键能___________ (填“>”“<”或“=”,下同)生成物的总键能,反应历程a、b的反应热___________ (填“相同”或“不相同”)。
(1)
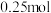
 完全燃烧生成液态水时放出341.7kJ热量,则表示
完全燃烧生成液态水时放出341.7kJ热量,则表示 燃烧热的热化学方程
燃烧热的热化学方程(2)已知:
 键的键能是
键的键能是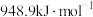 ,
, 键的键能是
键的键能是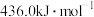 ,
, 键的键能是
键的键能是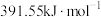 ,则
,则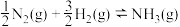

(3)已知:①
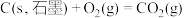
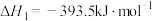
②


③


则298K时反应
 的焓变:
的焓变:
(4)已知常温时红磷比白磷稳定,比较下列反应中
 的大小:
的大小:
 。
。①
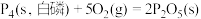

②


(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和

 的稀盐酸恰好完全反应,其反应热分别为
的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 的大小关系为
的大小关系为(6)如图所示,某反应在不同条件下的反应历程分别为a、b。

据图可判断出反应物的总键能
您最近一年使用:0次
名校
4 . 已知Fe2O2(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是
 C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是| A.-824.4kJ·mol-1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
您最近一年使用:0次
2024-03-18更新
|
380次组卷
|
4卷引用:海南省海桂中学2023-2024学年高二上学期12月教学检测(三)化学试题
5 . 根据下列反应和信息回答下列问题:
在25℃和101 kPa条件下,H2+F2=2HF
已知:
(1)该反应中反应物断裂化学键需要吸收的能量E吸收=___________ kJ,生成物形成化学键放出的能量E放出=___________ kJ,该反应属于___________ 反应(填“放热”或“吸热”),放出(或吸收)___________ kJ的热量。
(2)该反应的能量变化图是___________

在25℃和101 kPa条件下,H2+F2=2HF
已知:
| 化学键 | H-H | F-F | H-F |
| 键能(/kJmol) | 436 | 157 | 568 |
(1)该反应中反应物断裂化学键需要吸收的能量E吸收=
(2)该反应的能量变化图是

您最近一年使用:0次
6 . 1868年狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的 氧化
氧化 气体制取
气体制取 的方法,称为“地康法”。其反应原理为
的方法,称为“地康法”。其反应原理为
 。回答下列问题:
。回答下列问题:
(1)已知部分共价键的键能如表所示。
根据键能数据计算上述反应的 =
=______  ,该反应在
,该反应在______ (填“较高”“较低”或“任何”)温度下能自发进行。
(2)在反应器中充入一定量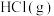 和
和 ,发生上述反应,测得
,发生上述反应,测得 的平衡转化率与压强、温度关系如图1所示。
的平衡转化率与压强、温度关系如图1所示。

①其他条件相同时,增大压强, 的平衡转化率增大的原因是
的平衡转化率增大的原因是______________________ 。
②下列物理量中, 点大于
点大于 点的是
点的是______ (填字母)。
A.正反应速率 B.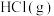 体积分数 C.混合气体的平均摩尔质量
体积分数 C.混合气体的平均摩尔质量
③若对P点体系升温,同时扩大容器体积使压强减小,达到新平衡时P点可能达到图中______ 点(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)一定温度下,向恒容密闭容器中充入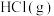 和
和 发生上述反应,测得平衡体系中
发生上述反应,测得平衡体系中 体积分数与起始投料比
体积分数与起始投料比 关系如图2所示。在
关系如图2所示。在 、
、 、
、 三点中,
三点中, 的平衡转化率最大的点是
的平衡转化率最大的点是______ 。若 点对应体系压强为
点对应体系压强为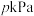 ,则该点平衡常数
,则该点平衡常数 =
=______  (列出计算式)。
(列出计算式)。
 氧化
氧化 气体制取
气体制取 的方法,称为“地康法”。其反应原理为
的方法,称为“地康法”。其反应原理为
 。回答下列问题:
。回答下列问题:(1)已知部分共价键的键能如表所示。
共价键 |
|
|
|
|
键能/( | 431.8 | 497.3 | 242.7 | 462.8 |
 =
= ,该反应在
,该反应在(2)在反应器中充入一定量
 和
和 ,发生上述反应,测得
,发生上述反应,测得 的平衡转化率与压强、温度关系如图1所示。
的平衡转化率与压强、温度关系如图1所示。
①其他条件相同时,增大压强,
 的平衡转化率增大的原因是
的平衡转化率增大的原因是②下列物理量中,
 点大于
点大于 点的是
点的是A.正反应速率 B.
 体积分数 C.混合气体的平均摩尔质量
体积分数 C.混合气体的平均摩尔质量③若对P点体系升温,同时扩大容器体积使压强减小,达到新平衡时P点可能达到图中
 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。(3)一定温度下,向恒容密闭容器中充入
 和
和 发生上述反应,测得平衡体系中
发生上述反应,测得平衡体系中 体积分数与起始投料比
体积分数与起始投料比 关系如图2所示。在
关系如图2所示。在 、
、 、
、 三点中,
三点中, 的平衡转化率最大的点是
的平衡转化率最大的点是 点对应体系压强为
点对应体系压强为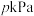 ,则该点平衡常数
,则该点平衡常数 =
= (列出计算式)。
(列出计算式)。
您最近一年使用:0次
7 . 已知热化学方程式:
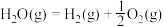
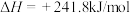
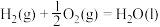
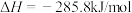
当1g液态水变为水蒸气时,其热量变化是
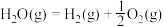
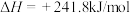
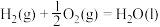
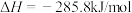
当1g液态水变为水蒸气时,其热量变化是
| A.吸热88kJ | B.吸热2.44kJ | C.放热44kJ | D.吸热44kJ |
您最近一年使用:0次
2024-03-07更新
|
54次组卷
|
2卷引用:海南省海口市秀英区某校2023-2024学年高二上学期期中检测化学试题
8 . 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)  =-890kJ/mol
=-890kJ/mol
CO(g)+1/2O2(g)=CO2(g) =-282.5kJ/mol。
=-282.5kJ/mol。
假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
 =-890kJ/mol
=-890kJ/molCO(g)+1/2O2(g)=CO2(g)
 =-282.5kJ/mol。
=-282.5kJ/mol。假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
| A.40% | B.50% | C.60% | D.70% |
您最近一年使用:0次
9 . 已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O  =Q1 kJ/mol
=Q1 kJ/mol
 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(1)
Na2SO4(aq)+H2O(1)  =Q2 kJ/mol
=Q2 kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) =Q3 kJ/mol
=Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
 =Q1 kJ/mol
=Q1 kJ/mol H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(1)
Na2SO4(aq)+H2O(1)  =Q2 kJ/mol
=Q2 kJ/molHNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1)
 =Q3 kJ/mol
=Q3 kJ/mol上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
您最近一年使用:0次
名校
10 . 氢能是一种极具发展潜力的清洁能源,目前有以下制取氢气的方法:
(1)水煤气变换制氢:

已知: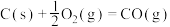
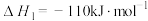
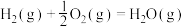
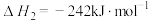


水煤气变换制氢体系中,一定时间内,CaO的添加情况与H2的体积分数关系如图。

①水煤气变换制氢反应的
_________ kJ·mol-1。
②添加CaO后H2的体积分数增大的原因是________ (用化学方程式表示)。
③纳米CaO和微米CaO相比,对应的H2体积分数更大的原因是:纳米CaO比微米CaO__________ 更大,从而与气体反应速率更快,相同时间内促进水煤气变换制氢反应正向进行的程度更大。
(2)甲醇水蒸气重整制氢: 。控制原料气
。控制原料气 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
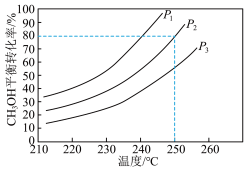
①甲醇水蒸气重整制氢反应在__________ 条件(填“高温”、“低温”或“任意温度”)下能自发进行。
②图中的压强由小到大的顺序是__________ ,理由是__________ 。
③温度为250℃、压强为 时,该反应的分压平衡常数
时,该反应的分压平衡常数
__________ (列出计算式,分压=总压×物质的量分数)。
(1)水煤气变换制氢:


已知:
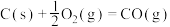
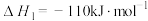
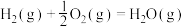
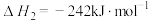


水煤气变换制氢体系中,一定时间内,CaO的添加情况与H2的体积分数关系如图。

①水煤气变换制氢反应的

②添加CaO后H2的体积分数增大的原因是
③纳米CaO和微米CaO相比,对应的H2体积分数更大的原因是:纳米CaO比微米CaO
(2)甲醇水蒸气重整制氢:
 。控制原料气
。控制原料气 ,体系中甲醇的平衡转化率与温度和压强的关系如图。
,体系中甲醇的平衡转化率与温度和压强的关系如图。
①甲醇水蒸气重整制氢反应在
②图中的压强由小到大的顺序是
③温度为250℃、压强为
 时,该反应的分压平衡常数
时,该反应的分压平衡常数
您最近一年使用:0次










