名校
解题方法
1 . 乙醇(C2H5OH)是生活中常见燃料,可以通过:
方法一,植物中淀粉类或者糖类物随采用发酵方式生产;
方法二,石油化学工业使用乙烯为原料合成。回答下列问题
(1)生物质能是人类解决能源危机的重要途径之· ,下列有关生物质能的说法正确的是______
A.利用生物质能就是间接利用太阳能
B.生物质能是可再生能源
C.生物质能的缺点是严重污染环境
D.生物质能是解决农村问题的重要途径
(2)乙醇可以直接用作燃料,也可以设计乙醇一空气燃料电池,以氢氧化钾溶液做电解质,写出负极的电极反应__________ ;若以熔融的碳酸盐做电解质,写出负极的电极反应式______ ;
(3)已知乙醇的燃烧热为1366.8kJ/mol,根据下列反应的反应热:
C(s)+O2(g)═2CO2(g) △H=-393.5kJ·mol-1
H2(g)+ O2(g)=H2O(1) △H=-285.8 kJ/mol
O2(g)=H2O(1) △H=-285.8 kJ/mol
则理论上以C(s)、H2(g)、O2(g)为原料合成C2H5OH(1)的反应的热化学方程式为_________ 。
方法一,植物中淀粉类或者糖类物随采用发酵方式生产;
方法二,石油化学工业使用乙烯为原料合成。回答下列问题
(1)生物质能是人类解决能源危机的重要途径之· ,下列有关生物质能的说法正确的是
A.利用生物质能就是间接利用太阳能
B.生物质能是可再生能源
C.生物质能的缺点是严重污染环境
D.生物质能是解决农村问题的重要途径
(2)乙醇可以直接用作燃料,也可以设计乙醇一空气燃料电池,以氢氧化钾溶液做电解质,写出负极的电极反应
(3)已知乙醇的燃烧热为1366.8kJ/mol,根据下列反应的反应热:
C(s)+O2(g)═2CO2(g) △H=-393.5kJ·mol-1
H2(g)+
 O2(g)=H2O(1) △H=-285.8 kJ/mol
O2(g)=H2O(1) △H=-285.8 kJ/mol 则理论上以C(s)、H2(g)、O2(g)为原料合成C2H5OH(1)的反应的热化学方程式为
您最近一年使用:0次
解题方法
2 . “二青会”火炬塔中使用的燃料是天然气,主要成分是甲烷,作为一种洁净环保的优质能源,几乎不含硫、粉尘和其他有害物质。
(1)已知:CH4的燃烧热为ΔH=-890kJ•mol-1,CO的燃烧热为ΔH=-283kJ•mol-1
①深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活。常温常压下,甲烷细菌使1mol甲烷生成CO2气体和液态水,放出的能量___ (填“<”“>”或“=”)890kJ。
②写出1molCH4(g)不完全燃烧生成CO(g)和H2O(l)的热化学方程式___ 。
(2)甲烷与CO2可用于制备合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4(g)参加以上反应可释放15.46kJ的热量,则如图中能表示该反应过程中能量变化的是___ (填字母)。

(3)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在一定条件下,CH4的平衡转化率与温度、压强的关系如图所示。则p1___ p2(填“<”“>”或“=”);A、B、C三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___ 。
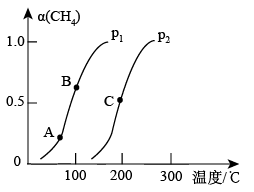
②在恒温恒压的密闭容器中,下列各项能作为判断该反应达到化学平衡状态依据的是___ (填字母)。
a.v(CH4)=v(CO)
b.混合气体的密度不发生变化
c.容器内混合气体的总压强不发生变化
d.一段时间内,用CH4表示的平均反应速率等于零
③将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4的转化率为50%,则反应前与平衡后,混合气体的平均相对分子质量之比为___ 。
(4)甲烷可以合成甲醇来代替日益供应紧张的燃油。工业上用甲烷为原料制备甲醇分为两个阶段:
①制备合成气:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
②合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)。实验室在恒温(500℃)、恒容(1L)密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,10min、40min、50min时分别测得容器中甲醇的浓度为0.60mol•L-1、0.80mol•L-1、0.80mol•L-1。则此条件下该反应开始10min内,H2的平均反应速率为__ ;平衡常数K的数值为___ 。
(1)已知:CH4的燃烧热为ΔH=-890kJ•mol-1,CO的燃烧热为ΔH=-283kJ•mol-1
①深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活。常温常压下,甲烷细菌使1mol甲烷生成CO2气体和液态水,放出的能量
②写出1molCH4(g)不完全燃烧生成CO(g)和H2O(l)的热化学方程式
(2)甲烷与CO2可用于制备合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4(g)参加以上反应可释放15.46kJ的热量,则如图中能表示该反应过程中能量变化的是

(3)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①在一定条件下,CH4的平衡转化率与温度、压强的关系如图所示。则p1

②在恒温恒压的密闭容器中,下列各项能作为判断该反应达到化学平衡状态依据的是
a.v(CH4)=v(CO)
b.混合气体的密度不发生变化
c.容器内混合气体的总压强不发生变化
d.一段时间内,用CH4表示的平均反应速率等于零
③将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4的转化率为50%,则反应前与平衡后,混合气体的平均相对分子质量之比为
(4)甲烷可以合成甲醇来代替日益供应紧张的燃油。工业上用甲烷为原料制备甲醇分为两个阶段:
①制备合成气:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
②合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)。实验室在恒温(500℃)、恒容(1L)密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,10min、40min、50min时分别测得容器中甲醇的浓度为0.60mol•L-1、0.80mol•L-1、0.80mol•L-1。则此条件下该反应开始10min内,H2的平均反应速率为
您最近一年使用:0次
名校
3 . 甲烷是最简单的烃,可用来作为燃料,也是一种重要的化工原料。
(1)A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
C. CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445.15 kJ/mol
CO2(g)+H2O(l) ΔH=-445.15 kJ/mol
根据上述热化学方程式,甲烷燃烧热是_______ ,H2O(l)=H2O(g) ΔH=_______ kJ/mol。
(2)以水煤气为原料通过以下反应可以合成甲醇CO(g)+2H2(g)⇌CH3OH(g) △H=-90.1 kJ/mol 。现将2 mol H2 (g)和1 mol CO (g)充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①T1时增大压强,n(CH3OH)_______ (填“增大”、“减小”或“不变”);T1_______ T2(填“>”、“<”或“=”);
②A、B、C点对应的化学反应速率由大到小的顺序为_______ (用v(A)、v(B)、v(C)表示);
③若B点,n(CH3OH)=0.8 mol,总压强为2.5MPa,则T2温度下B点用分压强代替浓度表示的平衡常数Kp=_______ 。
(1)A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
C.
 CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445.15 kJ/mol
CO2(g)+H2O(l) ΔH=-445.15 kJ/mol根据上述热化学方程式,甲烷燃烧热是
(2)以水煤气为原料通过以下反应可以合成甲醇CO(g)+2H2(g)⇌CH3OH(g) △H=-90.1 kJ/mol 。现将2 mol H2 (g)和1 mol CO (g)充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①T1时增大压强,n(CH3OH)
②A、B、C点对应的化学反应速率由大到小的顺序为
③若B点,n(CH3OH)=0.8 mol,总压强为2.5MPa,则T2温度下B点用分压强代替浓度表示的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
4 . 随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=_____ kJ·mol-1。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是____ kJ。
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
则该反应的ΔH=____ kJ·mol-1。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。
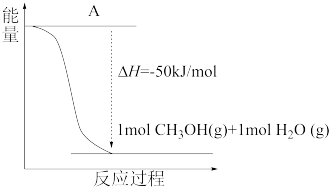
补全上图:图中A处应填入_______ 。
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。
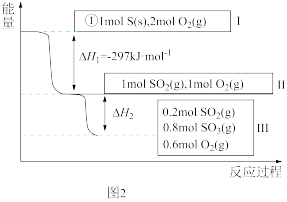
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:____ 。
②ΔH2=___ kJ·mol-1。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。

补全上图:图中A处应填入
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。

已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
您最近一年使用:0次
2020-11-26更新
|
192次组卷
|
4卷引用:江苏省启东市2020-2021学年高二上学期期中考试化学试题



