1 . 根据已知,回答下列问题。
(1)在 、
、 下,
下, 甲烷燃烧生成
甲烷燃烧生成 和液态水时放热
和液态水时放热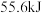 。则表示甲烷燃烧热的热化学方程式为
。则表示甲烷燃烧热的热化学方程式为______ 。
(2)常温常压下,断裂 (理想)气体分子化学键所吸收的能量或形成
(理想)气体分子化学键所吸收的能量或形成 (理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数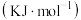
根据键能数据计算以下反应的反应热: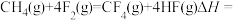
______ 。
(3)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.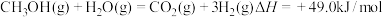
B.
由上述方程式可知, 的燃烧热
的燃烧热______ (填“大于”、“等于”或“小于”)
(4)火箭的常规燃料是液态四氧化二氮和液态肼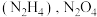 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:


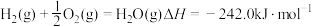
请写出肼和氟气反应的热化学方程式:______ 。
(1)在
 、
、 下,
下, 甲烷燃烧生成
甲烷燃烧生成 和液态水时放热
和液态水时放热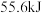 。则表示甲烷燃烧热的热化学方程式为
。则表示甲烷燃烧热的热化学方程式为(2)常温常压下,断裂
 (理想)气体分子化学键所吸收的能量或形成
(理想)气体分子化学键所吸收的能量或形成 (理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C-H | 414 | C-F | 489 | H-F | 565 |
| 436 |
| 391 |
| 158 |
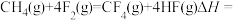
(3)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.
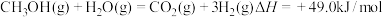
B.

由上述方程式可知,
 的燃烧热
的燃烧热
(4)火箭的常规燃料是液态四氧化二氮和液态肼
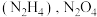 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。已知:


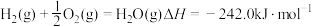
请写出肼和氟气反应的热化学方程式:
您最近一年使用:0次
名校
2 . 已知几种含碳物质间的转化及能量变化关系如图所示。
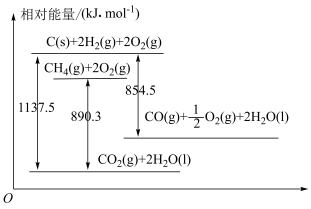
(1)写出表示CO燃烧热的热化学方程式:___________ 。
(2)反应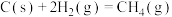

___________  ,该反应中反应物的总键能
,该反应中反应物的总键能___________ (填“大于”、“小于”或“等于”)生成物的总键能。若18gC(s)与 反应,完全转化成
反应,完全转化成 ,需要
,需要___________ (填“吸收”或“放出”)___________ kJ能量。
(3)在25℃、101kPa下,30g由 和CO组成的混合气体完全燃烧生成
和CO组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ。则混合气体中
和液态水,放出热量1031.8kJ。则混合气体中 和CO的物质的量分别为
和CO的物质的量分别为___________ mol、___________ mol。

(1)写出表示CO燃烧热的热化学方程式:
(2)反应
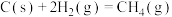

 ,该反应中反应物的总键能
,该反应中反应物的总键能 反应,完全转化成
反应,完全转化成 ,需要
,需要(3)在25℃、101kPa下,30g由
 和CO组成的混合气体完全燃烧生成
和CO组成的混合气体完全燃烧生成 和液态水,放出热量1031.8kJ。则混合气体中
和液态水,放出热量1031.8kJ。则混合气体中 和CO的物质的量分别为
和CO的物质的量分别为
您最近一年使用:0次
2023-11-21更新
|
138次组卷
|
2卷引用:河南省新乡市2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 研究化学反应中的能量变化对生产、生活有重要的意义。
(1)甲烷是一种高效清洁的新能源, 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为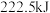 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)已知:


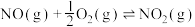


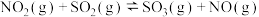


则
___________ (填含 、
、 的表达式),
的表达式),
___________ (填含 、
、 的表达式)。
的表达式)。
(3)已知: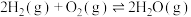
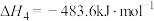 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:
①合成氨反应 的活化能
的活化能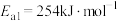 ,则氨分解反应
,则氨分解反应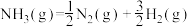 的活化能
的活化能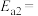
___________  。
。
②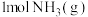 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出___________ kJ的热量;又已知
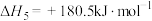 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为___________ 。
(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

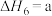
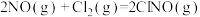
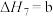
则反应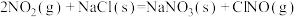 的
的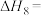
___________ (用含a、b的表达式表示)。
(1)甲烷是一种高效清洁的新能源,
 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为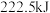 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)已知:



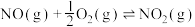


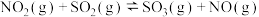


则

 、
、 的表达式),
的表达式),
 、
、 的表达式)。
的表达式)。(3)已知:
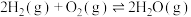
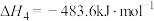 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:| 化学键 | H—H |  | N—H |
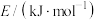 | 436 | 946 | 391 |
 的活化能
的活化能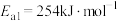 ,则氨分解反应
,则氨分解反应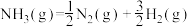 的活化能
的活化能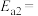
 。
。②
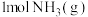 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出
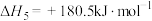 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

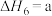
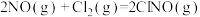
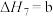
则反应
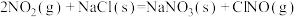 的
的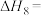
您最近一年使用:0次
2023-11-13更新
|
210次组卷
|
2卷引用:福建省泉州市2023-2024学年高二上学期期中考试化学试题
解题方法
4 . 填空。
(1)已知乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,请写出表示乙炔燃烧热的热化学方程式_______ 。
(2)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-560kJ·mol-l;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1;
①若用标准状况下4.48LCH4还原NO2生成N2,反应中转移的电子总数为_______ ,(用NA表示阿伏加德罗常数值),放出的热量为_______ kJ。
②若1molCH4还原NO2时放出的热量为710kJ,则生成的N2和NO的物质的量之比_______ 。
(1)已知乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,请写出表示乙炔燃烧热的热化学方程式
(2)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-560kJ·mol-l;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1;
①若用标准状况下4.48LCH4还原NO2生成N2,反应中转移的电子总数为
②若1molCH4还原NO2时放出的热量为710kJ,则生成的N2和NO的物质的量之比
您最近一年使用:0次
名校
解题方法
5 . 化学反应与能量
(1)已知



设有氢气和丙烷的混合气体5mol,完全燃烧时放出热量为3847kJ,则混合气体中氢气与丙烷的体积比是_______ 。
(2)甲醇( )广泛用作燃料电池的燃料,可由天然气来合成,已知:
)广泛用作燃料电池的燃料,可由天然气来合成,已知:
①

②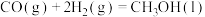
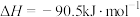
③
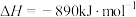
则甲醇的燃烧热为_______ 。
(3)向足量的 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量是5.12kJ。向足量的
溶液,放出的热量是5.12kJ。向足量的 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量为2.2kJ。则
溶液,放出的热量为2.2kJ。则 溶液与
溶液与 溶液反应的热化学方程式为
溶液反应的热化学方程式为


_______ 。
(4)已知:
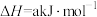

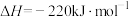
 、
、 和
和 键的键能分别为436、496和
键的键能分别为436、496和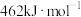 ,则a为
,则a为_______ 。
(1)已知




设有氢气和丙烷的混合气体5mol,完全燃烧时放出热量为3847kJ,则混合气体中氢气与丙烷的体积比是
(2)甲醇(
 )广泛用作燃料电池的燃料,可由天然气来合成,已知:
)广泛用作燃料电池的燃料,可由天然气来合成,已知:①


②
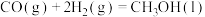
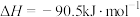
③

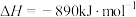
则甲醇的燃烧热为
(3)向足量的
 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量是5.12kJ。向足量的
溶液,放出的热量是5.12kJ。向足量的 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量为2.2kJ。则
溶液,放出的热量为2.2kJ。则 溶液与
溶液与 溶液反应的热化学方程式为
溶液反应的热化学方程式为

(4)已知:

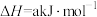

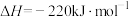
 、
、 和
和 键的键能分别为436、496和
键的键能分别为436、496和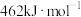 ,则a为
,则a为
您最近一年使用:0次
名校
解题方法
6 . 利用“萨巴蒂尔反应”[
 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。
已知:
试回答下列问题:
(1)①表示CO(g)燃烧热的热化学方程式:_______ 。
②C(s)燃烧仅生成CO(g)的热化学方程式:_______ ,当有6gC(s)完全燃烧时,放出_______ kJ热量。
(2)①若2mol由CO(g)、 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是_______ 。
②等质量的CO(g)、 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为_______ (用化学式表示)。
(3)每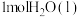 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

_______  。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为_______ (填含a的代数式) 。
。

 ]可在空间站上清除宇航员呼出的
]可在空间站上清除宇航员呼出的 ,并产生供空间站在轨运行的火箭燃料。
,并产生供空间站在轨运行的火箭燃料。已知:
| 物质 | CO(g) |  |  | C(s) |
燃烧热/( ) ) | 283 | 285.8 | 890.3 | 393 |
(1)①表示CO(g)燃烧热的热化学方程式:
②C(s)燃烧仅生成CO(g)的热化学方程式:
(2)①若2mol由CO(g)、
 和
和 组成的混合气体完全燃烧生成
组成的混合气体完全燃烧生成 和
和 ,则其放出的热量(Q)的取值范围是
,则其放出的热量(Q)的取值范围是②等质量的CO(g)、
 和
和 完全燃烧生成
完全燃烧生成 和
和 时,放出的热量(Q)由大到小的顺序为
时,放出的热量(Q)由大到小的顺序为(3)每
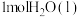 转化为
转化为 时需要吸收热量44kJ,则反应
时需要吸收热量44kJ,则反应

 。此反应逆反应活化能
。此反应逆反应活化能 ,则正反应活化能为
,则正反应活化能为 。
。
您最近一年使用:0次
2022-11-08更新
|
439次组卷
|
3卷引用:河北省邢台市南和区第一中学2022-2023学年高二上学期期中考试化学试题
名校
7 . CO、 、
、 是工业上重要的化工原料。
是工业上重要的化工原料。
已知:①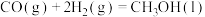
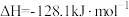
②
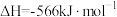
③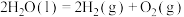
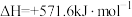
请回答下列问题:
(1)上述反应中属于放热反应的是_______ (填标号)。
(2)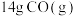 完全燃烧放出的热量为
完全燃烧放出的热量为_______ 。
(3)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
(4)1.5mol由CO和 组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、
组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、 的物质的量分别为
的物质的量分别为_______ mol、_______ mol。
(5)等质量的 、
、 、
、 完全燃烧,放热最多的是
完全燃烧,放热最多的是_______ (填化学式)。
(6)某些常见化学键的键能数据如下表:
则

_______  。
。
 、
、 是工业上重要的化工原料。
是工业上重要的化工原料。已知:①
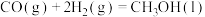
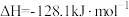
②

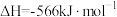
③
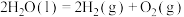
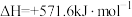
请回答下列问题:
(1)上述反应中属于放热反应的是
(2)
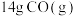 完全燃烧放出的热量为
完全燃烧放出的热量为(3)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(4)1.5mol由CO和
 组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、
组成的混合气体在足量氧气中充分燃烧放出的热量为425.9kJ,则混合气体中CO、 的物质的量分别为
的物质的量分别为(5)等质量的
 、
、 、
、 完全燃烧,放热最多的是
完全燃烧,放热最多的是(6)某些常见化学键的键能数据如下表:
| 化学键 | C=O | H—O | H—H |  |
键能 | 803 | 463 | 436 | 1076 |


 。
。
您最近一年使用:0次
2022-11-07更新
|
343次组卷
|
6卷引用:新疆维吾尔自治区新疆生产建设兵团部分名校2022-2023学年高二上学期期中联考化学试题
名校
8 . 完成下列填空
(1)已知下列两个热化学方程式: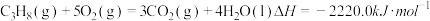 ,
,
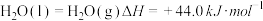 ,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为___________ kJ
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧热的热化学方程式:___________ 。
(3)足量H2在1molO2中完全燃烧生成 液态水,放出571.6kJ的热量,
液态水,放出571.6kJ的热量, 的燃烧热ΔH=
的燃烧热ΔH=___________ 。
(4)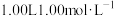 硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出
硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出 的热量,表示其中和热的热化学方程式为
的热量,表示其中和热的热化学方程式为___________ 。
(5)已知: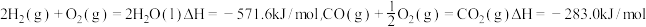 。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为___________ 。
(1)已知下列两个热化学方程式:
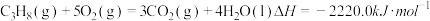 ,
,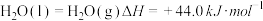 ,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧热的热化学方程式:
(3)足量H2在1molO2中完全燃烧生成
 液态水,放出571.6kJ的热量,
液态水,放出571.6kJ的热量, 的燃烧热ΔH=
的燃烧热ΔH=(4)
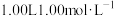 硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出
硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出 的热量,表示其中和热的热化学方程式为
的热量,表示其中和热的热化学方程式为(5)已知:
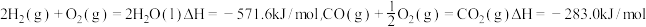 。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
您最近一年使用:0次
2021-12-18更新
|
400次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题
9 . (1)若5.2g乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ。该反应的热化学方程式为___________ ;乙炔的燃烧热为___________ kJ·mol-1。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___________ 。
(3)已知:2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1 ;4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1;则Al和FeO发生铝热反应的热化学方程式为:___________ 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(3)已知:2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1 ;4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1;则Al和FeO发生铝热反应的热化学方程式为:
您最近一年使用:0次
名校
解题方法
10 . 填空
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石___ (填“>”或“<”)石墨。
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1____ (填“>”或“<”)ΔH2。
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:________ 。
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=____ 。
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=______ 。
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是________ 。
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
2020-12-15更新
|
319次组卷
|
6卷引用:贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题
贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷河北省安平中学2017-2018学年高一下学期期末考试化学试题1(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题





