1 . 下列叙述正确的是
A.可逆反应X(g)+Y(g) Z(g)+W(s) ∆H>0,平衡后加入X,∆H增大 Z(g)+W(s) ∆H>0,平衡后加入X,∆H增大 |
B.反应CO(g)+H2O(g) CO2(g)+H2(g) ∆H<0,其他条件不变时升高温度,反应速率加快,反应放出的热量不变 CO2(g)+H2(g) ∆H<0,其他条件不变时升高温度,反应速率加快,反应放出的热量不变 |
| C.根据反应CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) H =-2878 kJ·mol−1 ;(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);H =-2869kJ·mol−1可知异丁烷的稳定性大于正丁烷 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
您最近一年使用:0次
名校
解题方法
2 . 在 、
、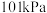 下,
下,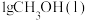 完全燃烧生成稳定氧化物放热
完全燃烧生成稳定氧化物放热 ,下列
,下列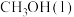 燃烧的热化学方程式正确的是
燃烧的热化学方程式正确的是
 、
、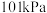 下,
下,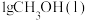 完全燃烧生成稳定氧化物放热
完全燃烧生成稳定氧化物放热 ,下列
,下列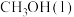 燃烧的热化学方程式正确的是
燃烧的热化学方程式正确的是A.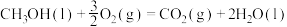 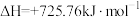 |
B.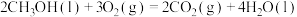 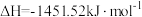 |
C.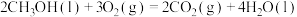 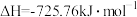 |
D.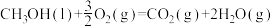 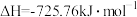 |
您最近一年使用:0次
2024-01-29更新
|
338次组卷
|
9卷引用:安徽省灵璧一中2021-2022学年高二上学期第一次月考化学试题
安徽省灵璧一中2021-2022学年高二上学期第一次月考化学试题天津市第十四中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题陕西省西安市周至县第四中学2021-2022学年高二上学期期中考试化学(理科)试题新疆乌鲁木齐市第二十中学2019-2020学年高二上学期期中考试化学试题陕西省西安中学2023-2024学年高二上学期第一次综合评价化学试题四川省攀枝花市2023-2024学年高二上学期普通高中教学质量监测化学试题江苏省2023-2024学年高一下学期学期3月月考化学试题江苏省新海高级中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
3 . 下列依据热化学方程式得出的结论正确的是
A.已知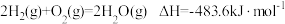 ;则氢气的燃烧热为 ;则氢气的燃烧热为 |
B.已知 ;则金刚石比石墨稳定 ;则金刚石比石墨稳定 |
C.已知 ;则含 ;则含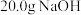 的稀溶液与稀盐酸完全中和,放出 的稀溶液与稀盐酸完全中和,放出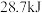 的热量 的热量 |
D.已知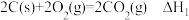 , ,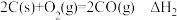 ;则 ;则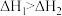 |
您最近一年使用:0次
2024-01-09更新
|
234次组卷
|
37卷引用:北京市第三十一中学2021-2022学年高二上学期期中考试化学试题
北京市第三十一中学2021-2022学年高二上学期期中考试化学试题安徽省定远县第三中学2018-2019学年度下学期高二化学开学检测卷山西省朔州市怀仁一中2018-2019学年高二上学期第三次月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期期中考试化学试题江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题黑龙江省双鸭山市第一中学2022-2023学年高二10月月考化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题河南省郑州外国语学校2022-2023学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题河南省郑州外国语学校2022-2023学年高二上学期期中考试化学试题湖南省永州市宁远县明德湘南中学2022-2023学年高二上学期第一次月考化学试题黑龙江省肇东市第四中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市第一中学2022-2023学年高二下学期入学考试化学试题 河南省南阳市2022-2023学年高二上学期期终质量评估化学试题广东番禺中学2022-2023学年高二上学期期末测试化学试题广东省佛山市实验中学2022-2023学年高二上学期第一次段考化学试题辽宁省名校联盟2023-2024学年高二上学期期初考试化学试题辽宁省锦州市黑山县名校联盟试2023-2024学年高二上学期开学考试化学试题四川省南充高级中学2023-2024学年高二上学期10月月考化学试题江西省九江市庐山市第一中学2022-2023学年高二上学期期末考试化学试题广东省湛江市第二十一中学2023-2024学年高二10月月考化学试题黑龙江省鹤岗市第三中学2023-2024学年高二上学期10月月考化学试题辽宁省辽西联合校2023-2024学年高二上学期期中考试化学试题福建省厦门市松柏中学2023-2024学年高二上学期10月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题广东省广州市真光中学2023-2024学年高二上学期12月月考化学试题四川省阆中东风中学校2023-2024学年高二上学期第二次段考化学试题四川省绵阳南山中学实验学校2023-2024学年高二上学期12月月考化学试题广东省江门市鹤山市第一中学2023-2024学年高二上学期第二阶段考试化学试题天津市南蔡村中学2023-2024学年高二上学期第二次月考化学试卷山东省威海大光华学校2023-2024学年高二11月月考化学试题广东省梅州市梅雁中学2023-2024学年高二上学期12月月考化学试题(已下线)2015届广西桂林市第十八中学高三上学期第二次月考化学试卷河北省深州中学2016-2017学年高一下学期期末考试化学试题【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高一下学期期中考试化学试题
名校
4 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
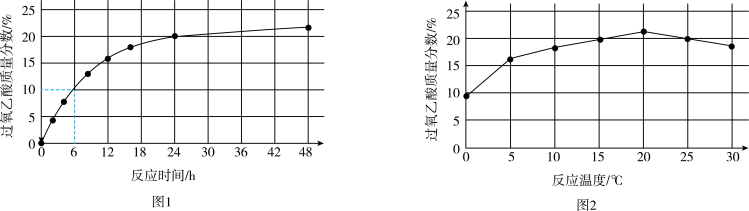 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
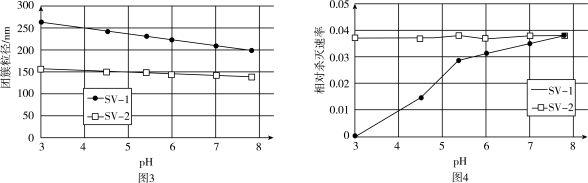
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近一年使用:0次
名校
5 . 25℃、101kPa下,32g甲醇完全燃烧生成液态水和二氧化碳时,放出763.3kJ热量,下列表示该反应的热化学方程式正确的是
| A.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-763.3kJ/mol |
| B.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) ΔH=-763.3 kJ |
| C.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) ΔH=-763.3 kJ/mol |
| D.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) ΔH=-763.3kJ/mol |
您最近一年使用:0次
2023-12-27更新
|
250次组卷
|
3卷引用:北京市中关村中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
6 . 结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压条件下测定)
| 选项 | 已知条件 | 热化学方程式 |
| A |  的燃烧热数值为a kJ/mol 的燃烧热数值为a kJ/mol |   |
| B | 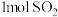 与足量 与足量 充分反应后,放出热量 充分反应后,放出热量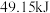 | 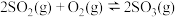 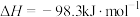 |
| C |  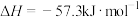 | 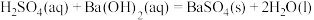 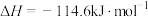 |
| D | 31g白磷比31g红磷能量多b kJ |  , ,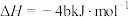 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-19更新
|
246次组卷
|
8卷引用:山西省太原市2021-2022学年高二上学期期中考试化学试题
18-19高一下·江苏·期中
名校
解题方法
7 .  是一种火箭燃料。已知在25℃、101 kPa下,
是一种火箭燃料。已知在25℃、101 kPa下,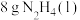 完全燃烧生成氮气和液态水时放出133.5 kJ热量。则下列热化学方程中正确的是
完全燃烧生成氮气和液态水时放出133.5 kJ热量。则下列热化学方程中正确的是
A.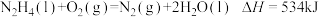 |
B.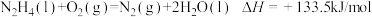 |
C.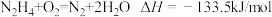 |
D.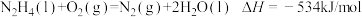 |
您最近一年使用:0次
2023-12-14更新
|
108次组卷
|
16卷引用:第一节 化学反应与能量的变化(第1课时 焓变 反应热)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)
(已下线)第一节 化学反应与能量的变化(第1课时 焓变 反应热)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.1 化学反应的焓变-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)黑龙江省大庆市第十中学2020-2021学年高二上学期开学考试化学试题黑龙江省绥化市明水县第一中学2020-2021学年高二上学期第一次月考化学试题黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题海南省海口市第一中学2023-2024学年高二上学期11月期中考试化学试题江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷江苏省沭阳县2018-2019学年高一下学期期中调研测试化学试题江苏省宿迁市宿豫中学2019-2020学年高一下学期四月调研试(奥赛班)化学试题山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题江苏省徐州市睢宁县古邳中学2019-2020学年高一下学期期中调研考试化学试卷江苏省盐城市大丰区新丰中学2019-2020学年高一下学期期中考试化学试题河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题黑龙江省佳木斯市建三江第一中学2021-2022学年高一下学期期末测试化学试题江苏省徐州市2022-2023学年高一下学期期中考试化学试题江苏省扬州中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
8 . 下列关于热化学方程式的说法正确的是
A.若 的燃烧热为a kJ⋅mol 的燃烧热为a kJ⋅mol ,则热化学方程式为 ,则热化学方程式为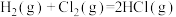  kJ⋅mol kJ⋅mol |
B.若1 mol  和0.5 mol 和0.5 mol  完全反应放热98.3 kJ,则热化学方程式为 完全反应放热98.3 kJ,则热化学方程式为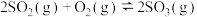  kJ⋅mol kJ⋅mol |
C.若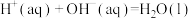 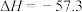 kJ⋅mol kJ⋅mol ,则稀硫酸与稀 ,则稀硫酸与稀 反应的热化学方程式为 反应的热化学方程式为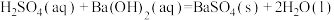  kJ⋅mol kJ⋅mol |
D.若3l g白磷的能量比3l g红磷多b kJ,则白磷转化为红磷的热化学方程式为 (白磷,s) (白磷,s) (红磷,s) (红磷,s)  kJ⋅mol kJ⋅mol |
您最近一年使用:0次
2023-10-12更新
|
318次组卷
|
65卷引用:江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷A卷化学试题
江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷A卷化学试题福建省武平县第一中学2021-2022学年高二上学期10月月考化学试题重庆市重庆实验外国语学校2021-2022学年高二上学期9月月考化学试题江苏省泰州中学2021-2022学年高二上学期第一次月度检测化学试题安徽省合肥市第六中学2021-2022学年高二上学期月考化学试题福建省泉州现代中学2021-2022学年高二上学期9月月考化学试题山东省济钢高级中学2021-2022学年高二上学期第二次教学检测化学试题山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点01 化学反应与能量-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)湖北省部分省级示范高中2021-2022学年高二上学期期中测试化学试题北京理工大学附属中学2021-2022学年高二上学期期中练习化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题广东省广雅中学2021-2022学年高二上学期期中考试化学试题辽宁省丹东市东港第二高级中学2021-2022学年高二上学期11月第二次教学检测化学试题宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题广东省广州真光中学2021-2022学年高二上学期期中考试化学试题(已下线)2018年12月20日 《每日一题》人教选修4-热化学方程式的书写与判断宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题黑龙江省牡丹江市第一高级中学2020-2021学年高二上学期8月开学考试化学试题(已下线)1.1.2 热化学方程式 燃烧热(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)第一章 化学反应的热效应(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省盘锦市第二高级中学2020-2021学年高二上学期第一次阶段性考试化学试题山东省济宁市实验中学2020-2021学年高二上学期10月月考化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题第一节 反应热 第2课时 热化学方程式 燃烧热黑龙江省双鸭山市第一中学2022-2023学年高二上学期开学考试化学试题 湖北省红安县第一中学2022-2023学年高二上学期9月考试化学试题湖北省襄阳市第五中学2022-2023学年高二上学期9月化学试题山东省青岛第二中学2022-2023学年高二上学期10月月考化学试题安徽省舒城中学2022-2023学年高二上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高二上学期期中考试化学试题福建省石狮市第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省兰州市第二中学2022-2023学年高二上学期期中考试化学试题广东省广州市育才中学2022-2023学年高二上学期期中考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期开学考试化学试题湖南省长沙市芙蓉高级中学2022-2023学年高二上学期期中考试化学试题广东省广州市从化区从化中学2022-2023学年高二上学期期中考试化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题四川省成都外国语学校2023-2024学年高二上学期10月月考化学试题福建省福州市连江尚德中学2023-2024学年高二上学期第一次诊断性测试化学试题广东省梅州市大埔县虎山中学2023-2024学年高二上学期10月期中考试化学试题(已下线)2018年9月10日 《每日一题》一轮复习-热化学方程式的书写百所名校联考-化学反应与能量(已下线)2019年9月9日《每日一题》2020年一轮复习—— 热化学方程式的书写(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)重庆市永川北山中学校2022-2023学年高三上学期期中质量监测化学试题(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题突破卷07 化学反应与能量?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省成都市成华区某校2023-2024学年高一上学期期中考试化学试题陕西省西安中学2023-2024学年高三上学期实验班11月练考理科综合能力测试题
解题方法
9 . “对比实验”是科学探究中的重要方法。请根据图回答下列问题:

(1)图甲铜片上白磷燃烧而水中白磷不燃烧,说明燃烧条件之一是________ 。
(2)图乙A中溶液呈紫红色,B中溶液无色,说明A中溶液呈紫红色的原因是________ 含有(填离子符号或名称)。
(3)图丙中铁钉最容易生锈的是________ (填序号)。自行车链条防锈措施是________ (任填一条)。

(1)图甲铜片上白磷燃烧而水中白磷不燃烧,说明燃烧条件之一是
(2)图乙A中溶液呈紫红色,B中溶液无色,说明A中溶液呈紫红色的原因是
(3)图丙中铁钉最容易生锈的是
您最近一年使用:0次
名校
10 . 自热化学链重整制氢 CLR(a)工艺的原理如图所示:
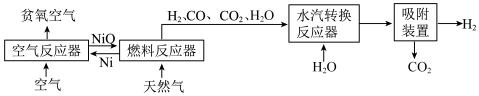
回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为___________ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:___________ 。
②K1、K2、K3之间的关系是:___________ ;
③在___________ (填“高温”或“低温”)情况下有利于反应Ⅲ的自发进行。
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=___________ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:___________ ;
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:___________ ;
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为___________ (结果保留 1 位小数)。

回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:
②K1、K2、K3之间的关系是:
③在
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为
您最近一年使用:0次



