解题方法
1 . 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡___________ 移动(填“向左”“向右”或“不”);,使用催化剂___________ 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)=O (g)+e-
(g)+e-  H1=+1175.7kJ·mol-1
H1=+1175.7kJ·mol-1
PtF6(g)+e- PtF
PtF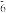 (g)
(g)  H2=-771.1kJ·mol-1
H2=-771.1kJ·mol-1
O PtF
PtF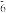 (s)=O
(s)=O (g)+PtF
(g)+PtF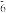 (g)
(g)  H3=+482.2kJ·mol-1
H3=+482.2kJ·mol-1
则反应O2(g)+PtF6(g)=O PtF
PtF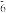 (s)的
(s)的 H=
H=___________ kJ·mol-1。
(1)合成氨反应反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)O2(g)=O
 (g)+e-
(g)+e-  H1=+1175.7kJ·mol-1
H1=+1175.7kJ·mol-1PtF6(g)+e-
 PtF
PtF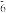 (g)
(g)  H2=-771.1kJ·mol-1
H2=-771.1kJ·mol-1O
 PtF
PtF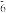 (s)=O
(s)=O (g)+PtF
(g)+PtF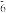 (g)
(g)  H3=+482.2kJ·mol-1
H3=+482.2kJ·mol-1则反应O2(g)+PtF6(g)=O
 PtF
PtF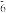 (s)的
(s)的 H=
H=
您最近一年使用:0次
名校
2 . 一种利用含硫物质热化学循环实现太阳能的转化与存储的构想如图所示,下列说法错误的是
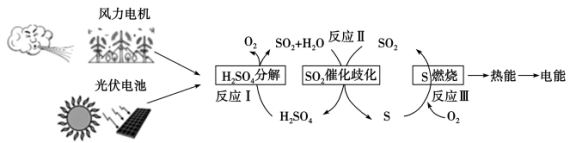
已知:反应Ⅰ: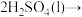 气态产物
气态产物 
反应Ⅲ: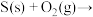 气态产物
气态产物 

已知:反应Ⅰ:
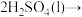 气态产物
气态产物 
反应Ⅲ:
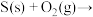 气态产物
气态产物 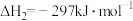
| A.该过程中存在太阳能转化为电能、电能转化为化学能等多种能量转化形式 |
| B.反应Ⅰ、Ⅱ、Ⅲ中的物质全部参与了循环 |
C.反应Ⅰ为: |
D.反应Ⅱ: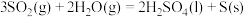 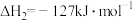 |
您最近一年使用:0次
2021-03-04更新
|
256次组卷
|
2卷引用:福建省尤溪第一中学2021-2022学年高二上学期第二次月考化学试题
解题方法
3 . (1)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为
C(金刚石·s)+O2(g)=CO2(g)ΔH1=-395.41kJ/mol-1,
C(石墨·s)+O2(g)=CO2(g)ΔH2=-393.51kJ/mol-1,则金刚石转化为石墨时的热化学方程式:____ ,由此看来更稳定的碳的同素异形体为_____ 。
(2)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.2kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:_______
C(金刚石·s)+O2(g)=CO2(g)ΔH1=-395.41kJ/mol-1,
C(石墨·s)+O2(g)=CO2(g)ΔH2=-393.51kJ/mol-1,则金刚石转化为石墨时的热化学方程式:
(2)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.2kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 已知: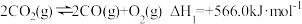
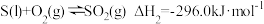 ,
,
已知某反应的平衡常数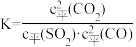 ,则该反应的
,则该反应的 等于
等于
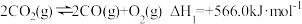
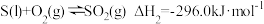 ,
,已知某反应的平衡常数
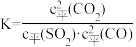 ,则该反应的
,则该反应的 等于
等于A.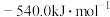 | B.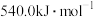 | C.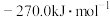 | D.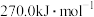 |
您最近一年使用:0次
2021-01-30更新
|
331次组卷
|
7卷引用:福建省宁化第一中学2021-2022学年高二上学期第一次阶段考试化学试题
5 . (1)氢能的优点是燃烧热值高,无污染。目前工业制氢气的一个重要反应为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH,反应过程和能量的关系如图所示:
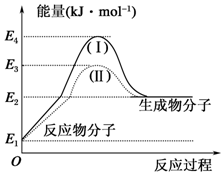
①CO(g)+H2O(g)=CO2(g)+H2(g)ΔH__ 0(填“>”“<”或“=”);
②过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热__ (填“相等”或“不相等”),原因是__ ;
③已知:H2(g)+ O2(g)=H2O(g)ΔH=-242.0kJ·mol-1
O2(g)=H2O(g)ΔH=-242.0kJ·mol-1
H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为__ 。
(2)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则
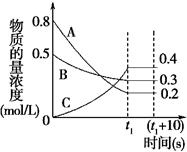
①该反应的化学方程式为:___ ;
②t1s时反应物A的转化率为:___ ;
③0~t1s内A的反应速率为(假设t1=6)v(A)=___ 。

①CO(g)+H2O(g)=CO2(g)+H2(g)ΔH
②过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热
③已知:H2(g)+
 O2(g)=H2O(g)ΔH=-242.0kJ·mol-1
O2(g)=H2O(g)ΔH=-242.0kJ·mol-1H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为
(2)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则

①该反应的化学方程式为:
②t1s时反应物A的转化率为:
③0~t1s内A的反应速率为(假设t1=6)v(A)=
您最近一年使用:0次
名校
6 . 已知:C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3,下列关于上述反应焓变的判断错误的是
| A.ΔH1>0 | B.ΔH2>0 | C.ΔH3<0 | D.ΔH1=ΔH2+ΔH3 |
您最近一年使用:0次
7 . 实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷,石墨,氢气燃烧的反应热:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
H2(g)+ O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=
O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=___ 。
C(石墨,s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
H2(g)+
 O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=
O2(g)=H2O(l)△H3=-285.8kJ/mol,则由石墨与氢气生成甲烷的反应热:C(石墨,s)+2H2(g)=CH4(g)ΔH4=
您最近一年使用:0次
8 . (1)由氢气和氧气反应生成1mol水蒸气放热242kJ,写出该反应的热化学方程式:___ 。
已知断裂1molH2、1molO2的化学键分别需要消耗436kJ、496kJ的能量,则断裂1molH-O所需的能量为____ kJ。
(2)已知:①CH4(g)+H2O(g) CO(g)+3H2(g)△H1=+205.9kJ•mol-1
CO(g)+3H2(g)△H1=+205.9kJ•mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1
则反应③:CH4(g)+CO2(g) 2CO(g)+2H2(g)△H3=
2CO(g)+2H2(g)△H3=___ kJ•mol-1。
写出反应③的平衡常数表达式K=___ 。
(3)若将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,则该电池正极的电极反应式为:____ 。
(4)如图所示,水槽中试管内有一枚铁钉,放置数天后观察,发现试管内液面上升,铁钉表面出现铁锈。该铁钉发生的电化学腐蚀类型为___ 腐蚀,其正极电极反应式为___ 。

已知断裂1molH2、1molO2的化学键分别需要消耗436kJ、496kJ的能量,则断裂1molH-O所需的能量为
(2)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g)△H1=+205.9kJ•mol-1
CO(g)+3H2(g)△H1=+205.9kJ•mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g)△H2=-41.2kJ•mol-1
CO2(g)+H2(g)△H2=-41.2kJ•mol-1则反应③:CH4(g)+CO2(g)
 2CO(g)+2H2(g)△H3=
2CO(g)+2H2(g)△H3=写出反应③的平衡常数表达式K=
(3)若将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,则该电池正极的电极反应式为:
(4)如图所示,水槽中试管内有一枚铁钉,放置数天后观察,发现试管内液面上升,铁钉表面出现铁锈。该铁钉发生的电化学腐蚀类型为

您最近一年使用:0次
11-12高二上·福建福州·阶段练习
名校
解题方法
9 . 肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(g) △H=+8.7 kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= - 534.0 kJ/mol
下列表示肼跟N2O4反应的热化学方程式正确的是
①N2(g)+2O2(g)=N2O4(g) △H=+8.7 kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= - 534.0 kJ/mol
下列表示肼跟N2O4反应的热化学方程式正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-542.7 kJ/mol |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1076.7 kJ/mol |
| C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-2153.4 kJ/mol |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1059.3 kJ/mol |
您最近一年使用:0次
2020-12-01更新
|
195次组卷
|
19卷引用:2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷
(已下线)2011-2012年福建省福州市罗源一中高二上学期第一次月考化学试卷2015-2016学年福建省福州八中高二上学期期末化学试卷(已下线)2012-2013学年江苏省宿迁青华中学高二下学期期中考化学普通班试卷(已下线)2013-2014学年江苏省常州市某重点中学高二上学期期中考试化学试卷2014-2015浙江省台州书生中学高二上学期第三次月考化学试卷2016-2017学年河南省郸城中学高二上第一次考试化学卷2016-2017学年山东省济南市长清一中高二上第一次质检化学卷【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题甘肃省岷县二中2018-2019学年高二上学期第一次月考化学试题(已下线)2018年12月21日 《每日一题》人教选修4-盖斯定律(已下线)2019年12月18日 《每日一题》化学人教版(选修4)——盖斯定律黑龙江省安达市第七中学2019-2020学年高二3月月考化学试题广东实验中学附属天河学校2020--2021学年高二上学期期中考试化学试题(已下线)2012-2013学年河北省存瑞中学高一下学期第三次月考化学试卷2015-2016学年河北省邢台一中高一下第一次月考化学试卷内蒙古杭锦后旗奋斗中学2018届高三上学期第三次月考化学试题湖北省仙桃市汉江高级中学2016-2017学年高一下学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题海南省北京师范大学万宁附中2020-2021学年高一下学期期中考试化学试题
名校
10 . (1)已知:①N2(g)+2O2(g)=N2O4(l)∆H1=-195kJ•mol-1 ②N2H4(l)+O2(g)=N2(g)+2H2O(g)∆H2=-534kJ•mol-1;写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:______
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
则H2(g)+Cl2(g)=2HCl(g)的反应热ΔH为_______
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
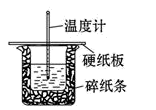
①从实验装置上看,图中尚缺少的一种玻璃用品是______ 。缺少用品不能改为金属(如铜),其原因是_________ 。
②烧杯间填满碎纸条的作用是_________ 。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值 会______ 。(填“偏大”、“偏小”、“无影响”)。
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②烧杯间填满碎纸条的作用是
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的
您最近一年使用:0次
2020-11-28更新
|
138次组卷
|
3卷引用:福建省永安市第一中学2020-2021学年高二上学期期中考试化学试题



