名校
解题方法
1 . 反应A(g)+B(g) = C(g) ΔH,分两步进行:①A(g)+B(g) = X(g)ΔH1 (慢)②X(g) = C(g) ΔH2(快)反应过程中能量变化如下图所示,下列说法正确的是


| A.ΔH1+ ΔH2=ΔH >0 | B.E2表示反应C(g) =X (g)的活化能 |
| C.E1是反应①的反应热 | D.整个反应的速率快慢由反应②决定 |
您最近一年使用:0次
2019-12-25更新
|
134次组卷
|
2卷引用:福建省漳平市第一中学2019-2020学年高二上学期第二次月考化学试题
解题方法
2 . 工业上可用水煤气(CO和H2)合成一系列有机物。
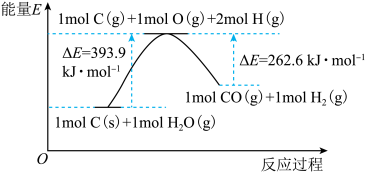
(1)根据下图写出固态碳和水蒸气反应生成CO和H2的热化学方程式:_________________________________________________ 。
(2)已知
① 2H2 (g)+CO(g) CH3OH (g) ΔH1
CH3OH (g) ΔH1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
③ CO(g)+H2O(g) CO2 (g)+H2(g) ΔH3
CO2 (g)+H2(g) ΔH3
则3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=
CH3OCH3(g)+CO2 (g) ΔH=_________ (用ΔH1、 ΔH2、ΔH3列出表达式)。
(3)一定条件下的密闭容器中,3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
反应达到平衡后,要提高CO的转化率,可以采取的措施是______ (填字母代号)。
A.高温 B.加入催化剂 C.高压 D.分离出二甲醚
(4)已知2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________ 。
③达到平衡后CH3OH的浓度为_____________ 。
(1)根据下图写出固态碳和水蒸气反应生成CO和H2的热化学方程式:

(2)已知
① 2H2 (g)+CO(g)
 CH3OH (g) ΔH1
CH3OH (g) ΔH1② 2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2③ CO(g)+H2O(g)
 CO2 (g)+H2(g) ΔH3
CO2 (g)+H2(g) ΔH3则3H2(g)+3CO(g)
 CH3OCH3(g)+CO2 (g) ΔH=
CH3OCH3(g)+CO2 (g) ΔH=(3)一定条件下的密闭容器中,3H2(g)+3CO(g)
 CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)反应达到平衡后,要提高CO的转化率,可以采取的措施是
A.高温 B.加入催化剂 C.高压 D.分离出二甲醚
(4)已知2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为
③达到平衡后CH3OH的浓度为
您最近一年使用:0次
名校
3 . 已知 25℃、101kPa 时:4Al(s)+3O2(g)→2Al2O3(s)+2835kJ
4Al(s)+2O3(g)→2Al2O3(s)+3119kJ
下列说法正确的是:
4Al(s)+2O3(g)→2Al2O3(s)+3119kJ
下列说法正确的是:
| A.O3 比 O2 稳定,由 O2 转化为 O3 是吸热反应 |
| B.O2 比 O3 稳定,由 O2 转化为 O3 是放热反应 |
| C.等质量的 O2 比 O3 能量高,由 O2 转化为 O3 是放热反应 |
| D.等质量的 O2 比 O3 能量低,由 O2 转化为 O3 是吸热反应 |
您最近一年使用:0次
2019-10-24更新
|
185次组卷
|
5卷引用:福建省福州市罗源第一中学2020-2021学年高二上学期10月月考化学试题
名校
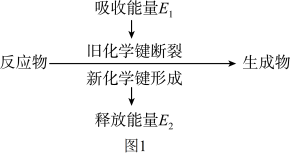
4 . (1)如图 1 是化学反应中物质变化和能量变化的示意图。在锌与稀盐酸的反应中,E1_____ E2 (填“>”或“<”或“=”)
(2)工业上利用 CO 和 H2在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
则 CO(g)+2H2(g)  CH3OH(g) △H=
CH3OH(g) △H=_____ kJ•mol-1
(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 50 mL 0.50 mol·L-1盐酸倒入如图装置的小烧杯中,测出盐酸温度。 b.用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并用另一温度计测出其温度。 c.将 NaOH 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。

①实验中,倒入 NaOH 溶液的正确操作是_____ 。
A.一次性快速倒入 B.分 3 次倒入 C.边搅拌边慢慢倒入
②若将各含 1mol 溶质的 NaOH 稀溶液、Ca(OH)2稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 Q1、Q2、Q3,则 Q1、Q2、Q3的关系为_____ 。
③假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。某学生实验后,处理数据,得到实验变化的温度为 3.20℃。该实验测得中和热ΔH =_____ (结果保留一位小数)。

(2)工业上利用 CO 和 H2在催化剂作用下合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
 CH3OH(g) △H=
CH3OH(g) △H=(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 50 mL 0.50 mol·L-1盐酸倒入如图装置的小烧杯中,测出盐酸温度。 b.用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并用另一温度计测出其温度。 c.将 NaOH 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。

①实验中,倒入 NaOH 溶液的正确操作是
A.一次性快速倒入 B.分 3 次倒入 C.边搅拌边慢慢倒入
②若将各含 1mol 溶质的 NaOH 稀溶液、Ca(OH)2稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 Q1、Q2、Q3,则 Q1、Q2、Q3的关系为
③假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。某学生实验后,处理数据,得到实验变化的温度为 3.20℃。该实验测得中和热ΔH =
您最近一年使用:0次
名校
5 . 联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=−1048.9 kJ·mol-1
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=−1048.9 kJ·mol-1
| A.ΔH4﹦2ΔH3−2ΔH2−ΔH1 |
B.O2(g)+2H2(g) 2H2O(l) ΔH5,ΔH5>ΔH3 2H2O(l) ΔH5,ΔH5>ΔH3 |
| C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g) |
| D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染 |
您最近一年使用:0次
2019-10-20更新
|
289次组卷
|
20卷引用:【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题
【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题福建省三明市第一中学2019-2020学年高二上学期第一次月考化学试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题福建省将乐县第一中学2021-2022学年高二上学期第一次月考化学试题福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题甘肃省师范大学附属中学2018-2019学年高二上学期第一次月考化学试题浙江省杭州市富阳区新登中学2018-2019学年高二上学期期末模拟化学试题吉林省靖宇县一中2019-2020学年上学期高二9月月考化学试题河北省沧州市肃宁县第一中学2019-2020学年高二上学期第三次月考化学试题河北省沧州市肃宁县第一中学2020-2021学年高二上学期第一次月考化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题安徽省合肥市合肥九中2020-2021学年高二上学期10月摸底考化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期开学考试化学试题江苏省苏州市实验中学2023-2024学年高二上学期10月月考化学试题江苏省徐州市2018届高三考前模拟检测化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)2018年11月浙江省普通高校招生选考科目考试化学仿真模拟试卷03(已下线)2019年1月浙江省普通高中学业水平考试化学仿真模拟试题03
6 . 同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1①
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH=-738.5 kJ·mol-1②
P4O10(s) ΔH=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为_______ 。相同状况下,能量状态较低的是______ ;白磷的稳定性比红磷的_______ (填“高”或“低”)。
已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1①
P(s,红磷)+
 O2(g)=
O2(g)= P4O10(s) ΔH=-738.5 kJ·mol-1②
P4O10(s) ΔH=-738.5 kJ·mol-1②则白磷转化为红磷的热化学方程式为
您最近一年使用:0次
2019-10-15更新
|
76次组卷
|
2卷引用:福建省宁德市福鼎六中2019-2020学年高二上学期第一次月考化学试题
名校
7 . 已知: ①Fe2O3(s)+3C(s,石墨) = 2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1;②C(s,石墨) +CO2(g) = 2CO(g) ΔH2=+172.5kJ·mol-1。则反应Fe2O3(s) +3CO(g) = 2Fe(s)+3CO2(g)的ΔH为( )
| A.-28.5kJ·mol-1 | B.-109kJ·mol-1 | C.+28.5kJ·mol-1 | D.+109kJ·mol-1 |
您最近一年使用:0次
2019-09-21更新
|
321次组卷
|
4卷引用:福建省泉州市泉港区第一中学2019-2020学年高二上学期第一次月考化学试题
真题
名校
8 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
您最近一年使用:0次
2019-01-30更新
|
1173次组卷
|
83卷引用:2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷
(已下线)2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷福建省东山第二中学2017-2018学年高二上学期期中考试化学试题福建省诗山县2017-2018学年高二上学期期中化学试题福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题福建省莆田第七中学2020-2021学年高二上学期期末考试化学试题(已下线)2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷(已下线)2010-2011学年江苏省扬州中学高二上学期期末考试化学试题(选修)(已下线)2010—2011学年辽宁省沈阳二中高二下学期期末考试化学试卷(已下线)2011-2012学年山东省宁阳四中高二上学期期中学分认定化学试卷(已下线)2011-2012学年湖南省望城一中高二上学期期中考试化学试卷(已下线)2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年河北省涿州二中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期末考试化学试卷(已下线)2011-2012学年山东省济宁市曲阜一中高二上学期期末模拟化学试卷(已下线)2011-2012学年云南蒙自高中高二上学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2011-2012学年河南省平顶山市高二上学期期末考试化学试卷(已下线)2011-2012学年河北省迁安市高二第一学期期中考试化学试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(已下线)2013-2014学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2014-2015学年山东省济南一中高二上学期期中化学试卷2013-2014山东省菏泽市高二上学期期末13校联考化学B试卷2014-2015学年云南省曲靖市陆良县二中高二下期中化学试卷2015-2016学年河北省定兴第三中学高二上学期第一次月考化学试卷2015-2016学年山东寿光中学高二上10月月考化学试卷2015-2016学年山西省太原五中高二上第一次月考化学试卷2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷2015-2016学年广东省湛江市高二上学期期末质检化学试卷2015-2016学年云南省开远四中高二下学期期中化学试卷2016-2017学年湖北省武钢三中高二上月考一化学卷2016-2017学年宁夏育才中学高二上学期期中化学卷2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷2016-2017学年黑龙江省牡丹江市第一高级中学高二上学期开学检测化学试卷山东省济宁市微山县第二中学2017-2018学年高二上学期第一次月考化学试题湖南省长沙市第一中学2017-2018学年高二上学期期中考试化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷山东省枣庄市第三中学2017-2018学年高二第六学段学情调查(1月)化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高二上学期第一次月考化学试题新疆疏勒县八一中学2018-2019学年高二上学期期末化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题山东省寿光市第一中学2018-2019学年高二上学期第一次月考化学试题天津市静海区四校2019-2020学年高二上学期9月联考化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题江西省南昌市第二中学2019-2020学年高二上学期第一次月考化学试题步步为赢 高二化学寒假作业:作业一 化学反应中的能量变化西藏自治区日喀则市南木林高级中学2019-2020学年高二上学期期中化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算贵州省毕节市实验高级中学2020-2021学年高二上学期第一次月考化学试题广东省佛山市萌茵实验学校2019-2020学年高二上学期第一次月考化学(理)试题宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题西藏林芝市第二高级中学2020-2021学年高二上学期期中考试理综化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题浙江省诸暨市2019-2020学年高二上学期期末考试化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题河南省正阳高中2020-2021学年高二下学期第三次素质检测化学试题辽宁省阜新市第二高级中学2021-2022学年高二上学期第一阶段考试化学试题吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题山东省淄博市第七中学2019-2020学年高二上学期第一次月考化学试题北京三中2021-2022学年高二上学期期中考试化学试题安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题西藏拉萨那曲高级中学2021-2022学年高二上学期期中考试化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学校2023-2024学年高二上学期期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题七 化学反应中的能量变化(已下线)2012届山东省淄博市第一中学高三上学期期中模块考试化学试卷(已下线)2011-2012学年度江西省临川十中上学期高三期末考试化学试卷(已下线)2013学年海南省琼海市嘉积中学高一下学期教学质量监测(二)理科化学卷2017届山东省枣庄三中高三上学期9月质检化学试卷2015-2016学年广东省湛江一中高一下期末化学试卷2017届河北省沧州一中高三上学期9.22周测化学卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)2020届高三化学二轮复习—— 化学能与热能【精编选择25题】内蒙古通辽市奈曼旗实验中学2018-2019学年高一下学期期末考试化学试题
9 . 已知在25℃时下述反应的有关数据:
C(s)+1/2 O2(g)=CO(g) △H1 =-110.5 kJ• mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ• mol-1
则C(s)+CO2(g)=2CO(g) 的△H 为
C(s)+1/2 O2(g)=CO(g) △H1 =-110.5 kJ• mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ• mol-1
则C(s)+CO2(g)=2CO(g) 的△H 为
| A.+283.5 kJ• mol-1 | B.+172.5 kJ• mol-1 |
| C.-172.5 kJ• mol-1 | D.-504 kJ• mol-1 |
您最近一年使用:0次
2019-01-18更新
|
292次组卷
|
38卷引用:福建省福州黎明中学2021-2022学年高二上学期期中考试化学试题
福建省福州黎明中学2021-2022学年高二上学期期中考试化学试题福建省福州第十五中学2022-2023学年高二上学期11月线上限时训练化学试题(已下线)09~10学年中山一中高二下学期第三次段考(已下线)2010年河北省唐山一中高二上学期期中考试化学卷(已下线)2011-2012学年广东省广州市第五中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年贵州省凯里一中高二上学期期中考试化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)2012-2013学年广东省汕头市达濠中学高二上学期期末理科化学试卷(已下线)2012-2013学年云南省大理州宾川县第四高级中学高二4月月考化学卷(已下线)2011-2012贵州省凯里一中第一学期期末考试高二化学试卷(已下线)2013-2014河北省邯郸市馆陶县第一中学高二7月调研考试化学试卷2015-2016学年广西钦州市钦南区高二上学期期中测试化学试卷2015-2016学年湖北荆州中学高二上期中测试化学试卷2015-2016学年山东省淄博市淄川一中高二上第一次阶段测化学试卷2015-2016学年黑龙江省哈尔滨六中高二上期末化学试卷2015-2016学年四川省成都市六校高二上学期期中联考化学试卷2016-2017学年北大附中河南分校高二上第一次月考化学卷2016-2017学年云南省曲靖市沾益一中高二上第一次月考化学卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷甘肃省嘉峪关市一中2017-2018学年高二上学期期末考试化学(理)试题宁夏回族自治区长庆高级中学2018-2019学年高二上学期期末考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题青海省海东市第二中学2020-2021学年高二4月月考化学试题贵州省贵阳市第三十七中学2021-2022学年高二上学期9月月考化学试卷广东省广州市北师大附中为明学校2021-2022学年高二10月月考化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题(已下线)河北省冀州中学10-11学年高一下学期期末考试(化学理)B卷2014-2015学年浙江省东阳中学高一下学期期中化学试卷2018届高三一轮复习化学:微考点46-盖斯定律的全面应用陕西省黄陵中学2017-2018学年高一(重点班)下学期期末考试化学试题黑龙江省佳木斯市第八中学2021-2022学年高一下学期期末考试化学试题
名校
10 . Mn2+催化H2O2分解:2H2O2(aq)===2H2O(l)+O2(g) ΔH1,其反应机理如下:
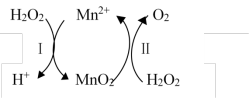
若反应Ⅱ的晗变为ΔH2,反应Ⅰ、Ⅱ的化学计量数均为最简整数比,则反应Ⅰ的焓变ΔH为

若反应Ⅱ的晗变为ΔH2,反应Ⅰ、Ⅱ的化学计量数均为最简整数比,则反应Ⅰ的焓变ΔH为
| A.ΔH1+ΔH2 | B.ΔH1-ΔH2 | C.2ΔH1-ΔH2 | D.ΔH1-2ΔH2 |
您最近一年使用:0次
2018-12-09更新
|
283次组卷
|
3卷引用:【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期期中考试化学试题



