解题方法
1 . 已知热化学方程式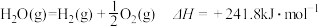 ,
,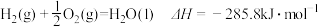 。当
。当 水蒸气变为液态水时,其焓变为
水蒸气变为液态水时,其焓变为
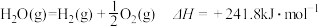 ,
,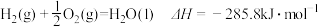 。当
。当 水蒸气变为液态水时,其焓变为
水蒸气变为液态水时,其焓变为A.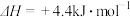 | B.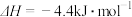 |
C.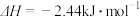 | D.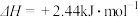 |
您最近一年使用:0次
2020-09-13更新
|
407次组卷
|
8卷引用:福建省南安市柳城中学2020-2021学年高二上学期第一次月考化学试题
2 . 1mol白磷转化为红磷放热18.39kJ,已知:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH= -akJ·mol-1(a>0);
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ·mol-1(b>0);
则a和b的关系是( )
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH= -akJ·mol-1(a>0);
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ·mol-1(b>0);
则a和b的关系是( )
| A.a<b | B.a>b | C.a=b | D.无法确定 |
您最近一年使用:0次
2020-09-11更新
|
232次组卷
|
29卷引用:福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题
福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题(已下线)2011-2012学年吉林省长春外国语学校高二第二次月考化学试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年云南大理云龙一中高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷2014-2015学年山西省曲沃中学校高二上学期期中化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷山西省运城市康杰中学2017-2018学年高二上学期第一次月考化学试题山东省枣庄市第八中学南校区高二10月份月考化学试题山东省枣庄市第八中学东校区2017-2018学年高二10月月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题山东省锦泽技工学校2017-2018学年高二10月月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题陕西煤铜川市炭建设公司第一中学2018-2019学年高二上学期10月月考化学试题(已下线)2018年10月20日 《每日一题》人教选修4-周末培优江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题吉林省实验中学2019-2020学年高二上学期第一次月考化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题广东省惠来县葵潭中学2019-2020学年高二上学期第二次月考化学试题甘肃省临夏中学2019-2020学年高二上学期第一次月考化学试题安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷2014-2015河北省正定中学高一下学期第一次月考化学试卷河北省安平中学2016-2017学年高一下学期升级考试化学试题吉林省长春市第二十九中学2019-2020学年高一下学期期中考试化学试题(理)新疆吾尔自治区哈密市第十五中学2019-2020学年高一下学期期末考试化学试题
3 . 煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后再使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为
a.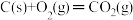 ΔH=E1①
ΔH=E1①
b.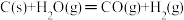 ΔH=E2②
ΔH=E2②
 ΔH=E3③
ΔH=E3③
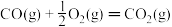 ΔH=E4④
ΔH=E4④
(1)上述四个热化学方程式中哪个反应的ΔH>0?______ (填序号)。
(2)等质量的煤分别通过以上两种不同的途径产生的可利用的总能量关系正确的是____ (填字母)。
A.a比b多 B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为E1=__________________ 。
(4)已知:①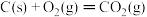 ΔH1=-393.5kJ/mol
ΔH1=-393.5kJ/mol
②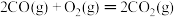 ΔH2=-566kJ/mol
ΔH2=-566kJ/mol
③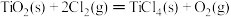 ΔH3=+141kJ/mol
ΔH3=+141kJ/mol
则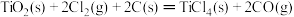 的ΔH=
的ΔH=_____________________ 。
a.
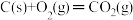 ΔH=E1①
ΔH=E1①b.
 ΔH=E2②
ΔH=E2② ΔH=E3③
ΔH=E3③ 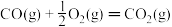 ΔH=E4④
ΔH=E4④(1)上述四个热化学方程式中哪个反应的ΔH>0?
(2)等质量的煤分别通过以上两种不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为E1=
(4)已知:①
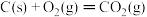 ΔH1=-393.5kJ/mol
ΔH1=-393.5kJ/mol②
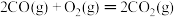 ΔH2=-566kJ/mol
ΔH2=-566kJ/mol③
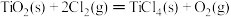 ΔH3=+141kJ/mol
ΔH3=+141kJ/mol 则
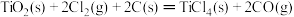 的ΔH=
的ΔH=
您最近一年使用:0次
2020-08-21更新
|
165次组卷
|
4卷引用:福建省南安市柳城中学2020-2021学年高二上学期第一次月考化学试题
4 . 如图所示,有关转化关系(X代表卤素)的说法正确的是
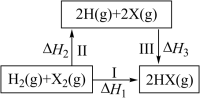

| A.△H越小,HX越不稳定 | B.按Cl、Br、I顺序,△H2依次减小 |
| C.△H3>0 | D.△H1+△H2+△H3=0 |
您最近一年使用:0次
2020-07-15更新
|
73次组卷
|
3卷引用:福建省漳州市华安县正兴学校2022-2023学年高二上学期期中联考化学试题
名校
解题方法
5 . 根据如下能量关系示意图,下列说法正确的是
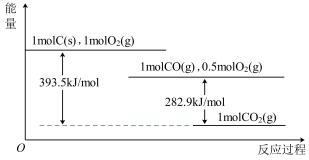

| A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ |
| B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= −221.2 kJ∙mol−1 |
| C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量 |
| D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH |
您最近一年使用:0次
2020-06-28更新
|
173次组卷
|
3卷引用:福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题
12-13高二上·陕西·期中
名校
解题方法
6 . 已知热化学方程式:
① C2H2(g) + O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
① C2H2(g) +
 O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+
 O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
您最近一年使用:0次
2020-05-31更新
|
642次组卷
|
29卷引用:福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题
福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013学年广东陆丰碣石中学高二第二次月考化学试卷(已下线)2015届黑龙江省牡丹江第一高中高二上学期期中考试化学(理)试卷河南省信阳市商城县高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第一章 第三节 化学反应热的计算四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题重庆市云阳县2019-2020学年高二上学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题云南省水富县云天化中学2020-2021学年高二下学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题四川省成都市简阳市阳安中学2022-2023学年高二上学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题安徽省滁州市明光中学2018-2019学年高一下学期期中考试化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题内蒙古乌兰察布市集宁一中2019-2020学年高一下学期期中考试化学试题江西省鹰潭市第一中学2019—2020学年高一下学期期末考试化学试题广东省江门市第二中学2020-2021学年高一下学期第一次考试化学试题黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题
解题方法
7 . 电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____ 。
(2)电化学法还原二氧化碳为乙烯原理如图所示。

A为电源的___ 极(填“正”或“负”),阴极电极反应式为___ 。电路中转移0.2mol电子,理论上产生氧气___ L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___ (填标号)。
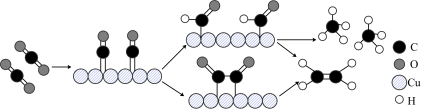
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=
(2)电化学法还原二氧化碳为乙烯原理如图所示。

A为电源的
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是

A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
您最近一年使用:0次
2020-05-16更新
|
233次组卷
|
2卷引用:福建省宁德市2019-2020学年高二上学期期末考试化学试题
名校
解题方法
8 . 下列关于热化学方程式的叙述正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ•mol -1,则H2燃烧热为241.8kJ•mol -1 |
| C.S(g)+O2(g) =SO2(g) ΔH1;S(s)+O2(g) =SO2(g) ΔH2 则ΔH1 < ΔH2 |
| D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ•mol-1,若将0.5 mol •L -1的稀 H2SO4与1 mol •L -1的NaOH的溶液等体积混合,放出的热量等于57.3 kJ |
您最近一年使用:0次
2020-01-24更新
|
995次组卷
|
7卷引用:福建省永安市第九中学2022-2023学年高二上学期9月月考化学试题
9 . 甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________ 。
(2)反应②中的能量变化如下图所示,则△H2=______ (用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________ (写出一点)
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1(1)甲醇蒸汽完全燃烧的热化学方程式为
(2)反应②中的能量变化如下图所示,则△H2=

(3)H2(g)的燃烧热为
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:
您最近一年使用:0次
2020-01-12更新
|
182次组卷
|
8卷引用:福建省莆田市第八中学2018-2019学年高二(理)上学期期中考试化学试题
名校
解题方法
10 . 已知:①N2(g)+3H2(g)=2NH3(g)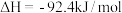 ;②2H2(g)+O2(g)=2H2O(g)
;②2H2(g)+O2(g)=2H2O(g)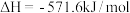 .则反应
.则反应 :
: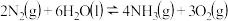 的
的 为
为

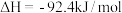 ;②2H2(g)+O2(g)=2H2O(g)
;②2H2(g)+O2(g)=2H2O(g)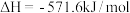 .则反应
.则反应 :
: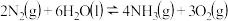 的
的 为
为

A.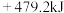 | B.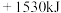 |
C.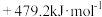 | D.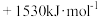 |
您最近一年使用:0次
2020-01-09更新
|
80次组卷
|
2卷引用:福建省福州市八县一中2019-2020学年高二上学期期中考试化学试题



