1 . 下图是合成氨反应和使用铁触媒作催化剂的催化历程。
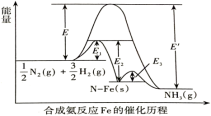
已知:① N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH1
NH3(g) ΔH1
② N2(g)+Fe(s)=N-Fe(s) ΔH2
N2(g)+Fe(s)=N-Fe(s) ΔH2
③N-FeS(s)+ H2(g)=NH3(g)+Fe(s) ΔH3
H2(g)=NH3(g)+Fe(s) ΔH3
下列说法正确的是

已知:①
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH1
NH3(g) ΔH1②
 N2(g)+Fe(s)=N-Fe(s) ΔH2
N2(g)+Fe(s)=N-Fe(s) ΔH2③N-FeS(s)+
 H2(g)=NH3(g)+Fe(s) ΔH3
H2(g)=NH3(g)+Fe(s) ΔH3下列说法正确的是
| A.反应①逆反应的活化能为E′ |
| B.ΔH2=E2-E1 |
| C.相同条件下,反应③的速率最慢 |
D.键能关系: E(N≡N)+ E(N≡N)+ E(H-H)>3E(N-H) E(H-H)>3E(N-H) |
您最近一年使用:0次
解题方法
2 . H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的•OH(羟基自由基),•OH可将有机物氧化降解。
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+ O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol
2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=___ kJ•mol-1。
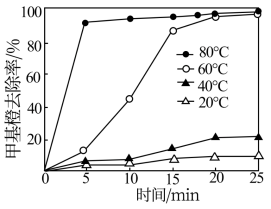
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是___ 。
(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为___ 。
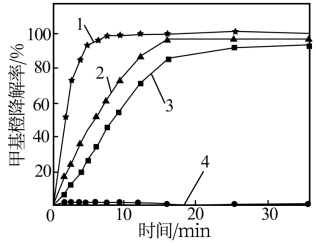
实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+
 O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是

(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
您最近一年使用:0次
3 . Ⅰ.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
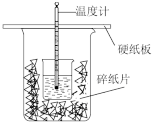
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________ ;由图可知此装置除了两烧杯没有填满碎泡沫塑料外,还有何不妥之处,应如何改正?___________ ;
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
Ⅱ.回答下列问题
(3)已知:①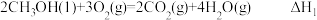 ,
,
②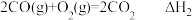 ,
,
③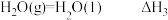 。
。
则反应 的
的 =
=___________ (用含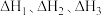 的式子表示)。
的式子表示)。
(4)某些化学键的键能如表所示:
试回答下列问题:
已知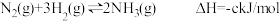 ,则N-H键的键能是
,则N-H键的键能是___________ kJ/mol (用含有a、b、c的式子表示)。
(5)1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中的能量变化如图所示,请写出NO2与CO反应的热化学方程式:___________ 。

(6)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷气体完全氧化生成CO2气体和液态水时放出热量50kJ,则表示丁烷燃烧热 的热化学方程式为___________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
Ⅱ.回答下列问题
(3)已知:①
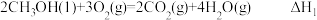 ,
,②
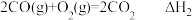 ,
,③
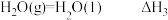 。
。则反应
 的
的 =
=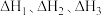 的式子表示)。
的式子表示)。(4)某些化学键的键能如表所示:
| 化学键 | H-H |  |
| 键能/(kJ/mol) | a | b |
已知
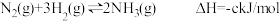 ,则N-H键的键能是
,则N-H键的键能是(5)1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中的能量变化如图所示,请写出NO2与CO反应的热化学方程式:

(6)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷气体完全氧化生成CO2气体和液态水时放出热量50kJ,则表示丁烷
您最近一年使用:0次
解题方法
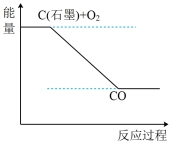
4 . Ⅰ.2SO2(g)+O2(g) 2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
(1)a=___ kJ•mol-1。
(2)该反应常用V2O5作催化剂,加入V2O5会使图中B点___ (填“升高”“降低”或“不变”),使图中ΔH___ (填“升高”“降低”或“不变”)。
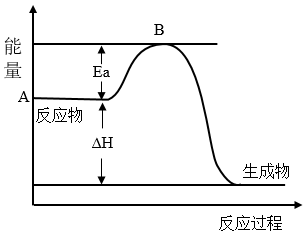
(3)已知单质硫的燃烧热为296kJ•mol-1,写出反应的热化学方程式:__ 。
(4)工业上用H2和Cl2反应制HCl,各键能数据为:H—H:436kJ/mol,Cl—Cl:243kJ/mol,H—Cl:431kJ/mol。该反应的热化学方程式是__ 。
(5)已知:
①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
 2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:(1)a=
(2)该反应常用V2O5作催化剂,加入V2O5会使图中B点

(3)已知单质硫的燃烧热为296kJ•mol-1,写出反应的热化学方程式:
(4)工业上用H2和Cl2反应制HCl,各键能数据为:H—H:436kJ/mol,Cl—Cl:243kJ/mol,H—Cl:431kJ/mol。该反应的热化学方程式是
(5)已知:
①C(s)+O2(g)=CO2(g) ΔH=ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
您最近一年使用:0次
名校
解题方法
5 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸,也可用于燃料电池等。
(1)工业合成氨的热化学方程式为: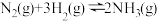
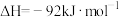
表中a为_______ 。
(2)合成氨原料中的 可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:
可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:
Ⅰ.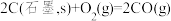
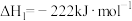
Ⅱ.
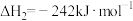
Ⅲ.

①25℃、101kPa下CO与水蒸气反应转化为 的热化学方程式为
的热化学方程式为_______ 。
②根据反应Ⅰ、Ⅱ、Ⅲ,下列说法正确的是_______ (填选项字母)。
a.由反应Ⅱ可以推知:
 ,则
,则 小于
小于
b.反应III的反应热等于 分子中化学键断裂时所吸收的总能量与
分子中化学键断裂时所吸收的总能量与 分子中化学键形成时所释放的总能量的差
分子中化学键形成时所释放的总能量的差
c.如图可表示反应Ⅰ的反应过程和能量的关系
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,氨燃料电池使用的电解质溶液是 的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备
的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备 ,装置如图所示。
,装置如图所示。
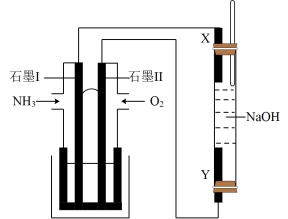
①石墨Ⅰ电极上的电极反应式为_______ 。
②Y电极的电极材料是_______ 。
③通电一段时间后,若右侧玻璃管中产生 白色沉淀,理论上石墨Ⅱ上通入
白色沉淀,理论上石墨Ⅱ上通入 的体积至少为
的体积至少为_______ L(标准状况下)。
(1)工业合成氨的热化学方程式为:
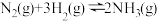
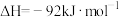
| 化学键 |  |  |  |
| 断开1mol化学键需要吸收的能量/kJ | a | 436 | 946 |
表中a为
(2)合成氨原料中的
 可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:
可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:Ⅰ.
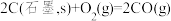
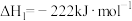
Ⅱ.

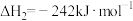
Ⅲ.


①25℃、101kPa下CO与水蒸气反应转化为
 的热化学方程式为
的热化学方程式为②根据反应Ⅰ、Ⅱ、Ⅲ,下列说法正确的是

a.由反应Ⅱ可以推知:

 ,则
,则 小于
小于
b.反应III的反应热等于
 分子中化学键断裂时所吸收的总能量与
分子中化学键断裂时所吸收的总能量与 分子中化学键形成时所释放的总能量的差
分子中化学键形成时所释放的总能量的差c.如图可表示反应Ⅰ的反应过程和能量的关系
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,氨燃料电池使用的电解质溶液是
 的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备
的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备 ,装置如图所示。
,装置如图所示。
①石墨Ⅰ电极上的电极反应式为
②Y电极的电极材料是
③通电一段时间后,若右侧玻璃管中产生
 白色沉淀,理论上石墨Ⅱ上通入
白色沉淀,理论上石墨Ⅱ上通入 的体积至少为
的体积至少为
您最近一年使用:0次
名校
解题方法
6 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
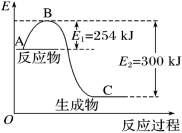
(1)上图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量变化示意图,请写出
(g)过程中能量变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:___________ 。
(2)NO与CO反应的热化学方程式可以表示为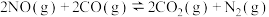
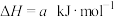 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___________ (填“增大”“减小”或“不变”)。
(3)用 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
①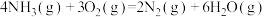
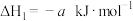
②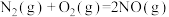
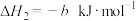
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热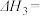
___________  (用含a、b的式子表示)。
(用含a、b的式子表示)。

(1)上图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量变化示意图,请写出
(g)过程中能量变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:(2)NO与CO反应的热化学方程式可以表示为
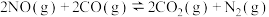
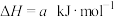 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a(3)用
 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:①
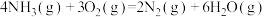
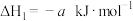
②
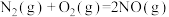
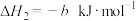
若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
 (用含a、b的式子表示)。
(用含a、b的式子表示)。
您最近一年使用:0次
名校
解题方法
7 . 请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
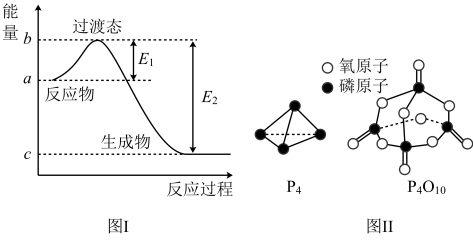
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___________ (填“增大”、“减小”或“不变”,下同),ΔH的变化是___________ 。请写出NO2和CO反应的热化学方程式:___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为___________ 。
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,(P4+5O2=P4O10)则表中x=___________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
(4)运动会中的火炬一般采用丙烷为燃料。丙烷燃烧放出的热量大,污染较小,是一种优良的燃料,表示丙烷燃烧热的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0kJ·mol-1.二甲醚(CH3OCH3)也是一种新型燃料,应用前景广阔,1 mol二甲醚完全燃烧生成CO2和H2O(l)时放出1 455 kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和H2O(l)时共放出1 645 kJ热量,则混合气体中丙烷和二甲醚的物质的量之比为___________ 。

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,(P4+5O2=P4O10)则表中x=
(4)运动会中的火炬一般采用丙烷为燃料。丙烷燃烧放出的热量大,污染较小,是一种优良的燃料,表示丙烷燃烧热的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0kJ·mol-1.二甲醚(CH3OCH3)也是一种新型燃料,应用前景广阔,1 mol二甲醚完全燃烧生成CO2和H2O(l)时放出1 455 kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和H2O(l)时共放出1 645 kJ热量,则混合气体中丙烷和二甲醚的物质的量之比为
您最近一年使用:0次
2021-10-22更新
|
185次组卷
|
3卷引用:福建省泉州科技中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 已知: ①C(s)+O2(g)=CO2(g); △H=-393.51kJ·mol-1
②C(s)+1/2O2(g)=CO(g); △H=-110.5kJ·mol-1
则反应2CO(g)=C(s)+CO2(g)的△H为
②C(s)+1/2O2(g)=CO(g); △H=-110.5kJ·mol-1
则反应2CO(g)=C(s)+CO2(g)的△H为
| A.-172.51kJ·mol-1 | B.+283.01kJ·mol-1 | C.-283.01kJ·mol-1 | D.+172.51kJ·mol-1 |
您最近一年使用:0次
2021-10-19更新
|
170次组卷
|
4卷引用:福建省莆田第二十五中学2021-2022学年高二上学期期末考试化学试题
福建省莆田第二十五中学2021-2022学年高二上学期期末考试化学试题河北省沧州市东光县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)期中试卷02-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)新疆维吾尔自治区皮山县高级中学2023-2024学年高二上学期1月期末化学试题
9 . 由金红石(TiO2) 制取单质钛过程中涉及的步骤为: TiO2 →TiCl4→Ti
已知:C(s)+ O2(g)= CO2(g) ΔH1
2CO(g) + O2(g)= 2CO2(g) ΔH2
TiO2(s) + 2Cl2(g) = TiCl4(g) + O2(g) △H3
则反应TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g)的ΔH等于
已知:C(s)+ O2(g)= CO2(g) ΔH1
2CO(g) + O2(g)= 2CO2(g) ΔH2
TiO2(s) + 2Cl2(g) = TiCl4(g) + O2(g) △H3
则反应TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g)的ΔH等于
| A.2ΔH1+ΔH2+ΔH3 | B.△H2- 2ΔH1-△H3 |
| C.ΔH1-ΔH2+ ΔH3 | D.2ΔH1-△H2+△H3 |
您最近一年使用:0次
2021-08-02更新
|
384次组卷
|
4卷引用:福建省永安市第三中学高中校2021-2022学年高二上学期10月月考化学试题
10 . 已知下列热化学方程式:
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+ O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+
 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是
| A.-260.4 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-441.8 kJ·mol-1 |
您最近一年使用:0次
2021-07-26更新
|
707次组卷
|
55卷引用:2010年福建省厦门市杏南中学高二上学期10月月考理科化学卷
(已下线)2010年福建省厦门市杏南中学高二上学期10月月考理科化学卷福建省泉州市泉港区第一中学2017-2018学年高二下学期第一次(4月)月考化学试题福建省泉州第十六中学2019-2020学年高二10月份月考化学试题福建省泉州现代中学2021-2022学年高二上学期9月月考化学试题(已下线)2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2011学年浙江省瑞安十校高二第二学期期中联考化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014-2015学年广东阳东县第二中学高二10月月考化学(理)试卷2015-2016学年青海省高级中学高二上9月质检化学试卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷广东省肇庆市实验中学2017-2018学年高二上学期期中考试化学(理)试题云南省峨山彝族自治县第一中学2017-2018学年高二12月月考(理)化学试题河南省郑州市第106中学2018-2019学年高二上学期第一次月考化学试题甘肃省岷县一中2018-2019学年高二上学期期中考试化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题山西省忻州二中2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二上学期1月质量检测化学试题【全国百强校】河南省实验中学2018-2019学年高二上学期期中考试化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2019-2020学年高二上学期期中考试化学试题江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题甘肃省白银市会宁县第二中学2017-2018学年高二上学期期中考试理科化学试题河南省安阳市林州市第一中学2019-2020学年高二下学期4月月考化学试题北京市海淀区中关村中学2019-2020学年高二下学期期末练习化学试题山西省临猗县临晋中学2020-2021学年高二9月月考化学试题陕西省渭南市临渭区尚德中学2020-2021学年高二上学期第一次月考化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期中考试化学(理)试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题天津市滨海新区汉沽第六中学2020-2021学年高二上学期期中化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)河北省唐山市2020-2021学年高二上学期期末考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期开学考试化学试题河南省汤阴县五一中学2019-2020学年高二上学期期中考试化学试题贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题山东省新泰市第二中学2021-2022学年上学期高二阶段性测试(一)化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题海南省三亚华侨学校(南新校区)2021-2022学年高二上学期期中考试化学试题江西省瑞金市第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题(已下线)2015届内蒙古巴彦淖尔市第一中学高三10月月考化学试卷黑龙江省鸡西市第十九中学2019届高三上学期期中考试化学试题甘肃省白银市靖远县第四中学2021届高三上学期10月月考化学试题(已下线)第17讲 化学能与热能(精讲)-2022年一轮复习讲练测(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练云南省保山市智源高级中学2023-2024学年高一下学期4月期中考试化学试题



