名校
解题方法
1 . 汽车内燃机工作时引起反应: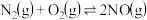 ,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
(1)机动车发动机工作时会引发 和
和 的反应,该反应是
的反应,该反应是_______ (填“放热”或“吸热”)反应。
(2) 与
与 合成NO的热化学方程式可以表示为
合成NO的热化学方程式可以表示为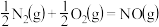
 ,则
,则
_______ 。
(3)NO与CO反应的热化学方程式可以表示为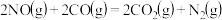
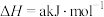 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a_______ (填“增大”“减小”或“不变”)。
(4)已知:①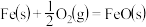
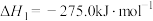 ;
;
②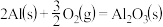
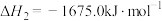 。
。
Al和FeO发生铝热反应的热化学方程式是_______ 。
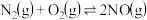 ,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:| 断裂的共价键 | O=O | N≡N | N-O |
| 需要的能量 | 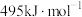 | 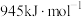 | 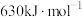 |
 和
和 的反应,该反应是
的反应,该反应是(2)
 与
与 合成NO的热化学方程式可以表示为
合成NO的热化学方程式可以表示为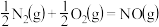
 ,则
,则
(3)NO与CO反应的热化学方程式可以表示为
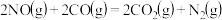
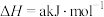 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a
,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a(4)已知:①
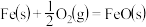
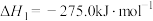 ;
;②
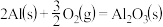
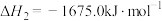 。
。Al和FeO发生铝热反应的热化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 完成下列问题。
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:_______ 。
②该实验①、②可探究_______ 对反应速率的影响,因此V3是_______ ;实验①、③可探究_______ 对反应速率的影响,因此V5是_______ 。
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=_______ 。
②该反应为_______ 反应(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为_______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向_______ (填“正向”或“逆向”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ ΔH2(填“>”或“<”)。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:
②该实验①、②可探究
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
您最近一年使用:0次
2022-08-29更新
|
170次组卷
|
2卷引用:福建省三明第一中学2022-2023学年高二上学期第一次月考化学试题
3 . 请回答以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是___________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
(2)打火机使用的燃料一般是丙烷(C3H8)。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式___________ ;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的ΔH=___________
(3)已知:H—H键的键能为436kJ·mol-1,H—N键的键能为391kJ·mol-1,根据化学方程式:N2+3H2⇌2NH3 ΔH=-92.4kJ·mol-1
①请计算出N≡N键的键能为___________ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量___________ 92.4kJ(填大于或小于或等于)。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是___________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的ΔH=
(3)已知:H—H键的键能为436kJ·mol-1,H—N键的键能为391kJ·mol-1,根据化学方程式:N2+3H2⇌2NH3 ΔH=-92.4kJ·mol-1
①请计算出N≡N键的键能为
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量
您最近一年使用:0次
2022-07-22更新
|
1539次组卷
|
9卷引用:福建省福安市第一中学2022-2023学年高二上学期第一次月考化学试题
福建省福安市第一中学2022-2023学年高二上学期第一次月考化学试题福建省宁德第一中学2020-2021学年高二上学期第一次月考化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题山东省邹城市第一中学2020-2021学年高二上学期期中质量检测化学试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题上海市东华大学附属奉贤致远中学2023-2024学年高二上学期期中考试化学(等级)试题
名校
解题方法
4 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,请回答下列问题:
(1)用 催化还原
催化还原 可以消除氮氧化物的污染,例如:
可以消除氮氧化物的污染,例如:

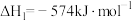

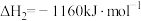
写出1mol 还原
还原 生成
生成 、
、 和气态水的热化学方程式
和气态水的热化学方程式_______ 。
(2)合成氨工业在国民生产中有重要意义。在容积为2L的恒温密闭容器中加入0.1mol的 和0.3mol的
和0.3mol的 在一定条件下发生反应:
在一定条件下发生反应:
 ,在5min时反应恰好达到平衡,此时测得
,在5min时反应恰好达到平衡,此时测得 的物质的量为0.1mol。
的物质的量为0.1mol。
①这段时间内用 表示的反应速率为
表示的反应速率为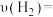
_______ 
②平衡后,若要再提高反应速率,且增大 的产率,可以采取的措施有
的产率,可以采取的措施有_______ 。(答一条即可)
③下列各项能作为判断该反应达到化学平衡状态的依据是_______ (填序号字母)。
A.容器内 、
、 、
、 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2
B.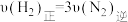
C.混合气体的密度保持不变
D.容器内压强保持不变
(3)已知合成氨反应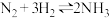 在400℃时的平衡常数
在400℃时的平衡常数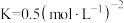 。在400℃时,测得某时刻
。在400℃时,测得某时刻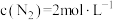 、
、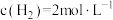 、
、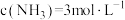 ,此时刻该反应的
,此时刻该反应的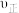
_______ 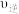 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)如图表示合成氨在恒压密闭容器中,不同温度下,达到平衡时 的体积百分数与投料比[
的体积百分数与投料比[ ]的关系。
]的关系。
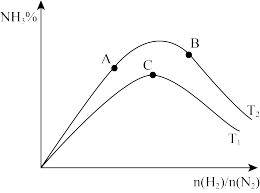
由此判断 、
、 、
、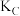 的大小关系为:
的大小关系为:_______ 。
(1)用
 催化还原
催化还原 可以消除氮氧化物的污染,例如:
可以消除氮氧化物的污染,例如:
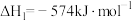

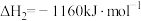
写出1mol
 还原
还原 生成
生成 、
、 和气态水的热化学方程式
和气态水的热化学方程式(2)合成氨工业在国民生产中有重要意义。在容积为2L的恒温密闭容器中加入0.1mol的
 和0.3mol的
和0.3mol的 在一定条件下发生反应:
在一定条件下发生反应:
 ,在5min时反应恰好达到平衡,此时测得
,在5min时反应恰好达到平衡,此时测得 的物质的量为0.1mol。
的物质的量为0.1mol。①这段时间内用
 表示的反应速率为
表示的反应速率为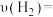

②平衡后,若要再提高反应速率,且增大
 的产率,可以采取的措施有
的产率,可以采取的措施有③下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内
 、
、 、
、 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2B.
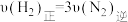
C.混合气体的密度保持不变
D.容器内压强保持不变
(3)已知合成氨反应
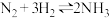 在400℃时的平衡常数
在400℃时的平衡常数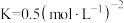 。在400℃时,测得某时刻
。在400℃时,测得某时刻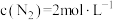 、
、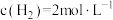 、
、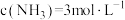 ,此时刻该反应的
,此时刻该反应的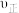
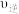 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)如图表示合成氨在恒压密闭容器中,不同温度下,达到平衡时
 的体积百分数与投料比[
的体积百分数与投料比[ ]的关系。
]的关系。
由此判断
 、
、 、
、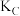 的大小关系为:
的大小关系为:
您最近一年使用:0次
2022-05-10更新
|
289次组卷
|
3卷引用:福建省莆田第一中学2021-2022学年高二下学期期中考试化学试题
5 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应不必加热就一定能发生 |
C.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 不同 不同 |
| D.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
您最近一年使用:0次
2022-03-20更新
|
146次组卷
|
2卷引用:福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
6 . 向 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是

 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
A.反应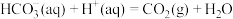 (1)为放热反应 (1)为放热反应 |
B. |
C.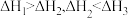 |
D. (1),若使用催化剂,则 (1),若使用催化剂,则 变小 变小 |
您最近一年使用:0次
2021-12-21更新
|
857次组卷
|
26卷引用:福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题
福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题宁夏银川一中2017-2018学年高二上学期第二次月考理综化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题(共建部)安徽省滁州市定远县炉桥中学2019-2020学年高二上学期第一次检测化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(理)试题湖南省衡阳市第八中学2019-2020学年高二下学期期中考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江西省彭泽县第一中学2020-2021学年高二上学期第一次月考化学试题江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题辽宁省庄河市高级中学2021-2022学年高二上学期开学考试化学试题浙江省温州市2021-2022学年高二上学期12月普通高中学考适应性测试化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题山东省实验中学2022-2023学年高二上学期10月月考化学试题浙江省北斗星盟2023-2024学年高二上学期12月月考化学试题2017届天津市五区县高三上学期期末考试化学试卷天津市五区县2017届高三上学期期末考试化学试卷天津市2018届高三第二学期高考模拟化学试题山东省潍坊市2019-2020学年高一下学期4月阶段考试化学试题安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题黑龙江省八校2021届高三摸底考试化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题湖南省常德市鼎城一中2022-2023学年高三第五次月考化学试题
名校
7 . 化学反应与能量变化是化学家研究的永恒话题。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把___ 能转化为___ 能的装置。
II.水煤气变换[CO(g)+H2O(g) CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
(2)在800℃、2L密闭容器中,若充入3molCO和2mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成1.2molCO2,则该反应的速率v(CO)为___ 。
(3)Shibata曾做过下列实验:721℃下,分别用氢气和一氧化碳还原氧化钴(CoO),反应如下。
i.H2(g)+CoO(s) Co(s)+H2O(g) △H1
Co(s)+H2O(g) △H1
ii.CO(g)+CoO(s) Co(s)+CO2(g) △H2
Co(s)+CO2(g) △H2
①反应CO(g)+H2O(g) CO2(g)+H2(g)△H=
CO2(g)+H2(g)△H=___ (用△H1、△H2表示)。
②一氧化碳和水蒸气的反应历程如图,下列说法正确的是___ 。
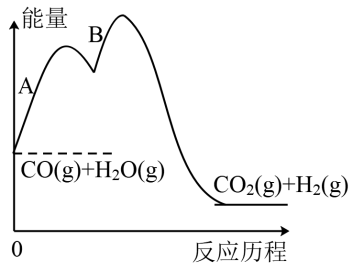
a.该反应放热
b.反应B活化能大于反应A
c.使用催化剂降低反应的△H,反应速率加快
d.该反应经过两步基元反应完成
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把
II.水煤气变换[CO(g)+H2O(g)
 CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。(2)在800℃、2L密闭容器中,若充入3molCO和2mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成1.2molCO2,则该反应的速率v(CO)为
(3)Shibata曾做过下列实验:721℃下,分别用氢气和一氧化碳还原氧化钴(CoO),反应如下。
i.H2(g)+CoO(s)
 Co(s)+H2O(g) △H1
Co(s)+H2O(g) △H1ii.CO(g)+CoO(s)
 Co(s)+CO2(g) △H2
Co(s)+CO2(g) △H2①反应CO(g)+H2O(g)
 CO2(g)+H2(g)△H=
CO2(g)+H2(g)△H=②一氧化碳和水蒸气的反应历程如图,下列说法正确的是

a.该反应放热
b.反应B活化能大于反应A
c.使用催化剂降低反应的△H,反应速率加快
d.该反应经过两步基元反应完成
您最近一年使用:0次
解题方法
8 . 已知热化学方程式:①H2(g) +  O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,
O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,
②H2(g) + O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是
O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是
 O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,
O2(g) = H2O(l) △H = -285.8 kJ∙mol-1,②H2(g) +
 O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是
O2(g) = H2O(g) △H = -241.8 kJ∙mol-1。下列说法正确的是| A.2H2(g) + O2(g) = 2H2O △H = -527.6 kJ∙mol-1 |
| B.H2O(g) = H2O(l) △H = +44 kJ∙mol-1 |
| C.①表示在298K时,由1mol H2(g)和0.5mol O2(g)反应生成1mol H2O(l)放出285.8kJ热量 |
D.②表示在298K时,1分子氢气和 分子氧气反应生成1 分子水蒸气放出241.8kJ热量 分子氧气反应生成1 分子水蒸气放出241.8kJ热量 |
您最近一年使用:0次
2021-12-06更新
|
143次组卷
|
2卷引用:福建省宁德市同心顺联盟校2021—2022学年高二上学期期中联考化学试题
9 . 在发射“神舟”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1,下列说法不正确的是
| A.ΔS>0 |
| B.相同条件下,正反应活化能大于逆反应活化能 |
| C.升高温度可以提高活化分子的百分数与百分含量 |
| D.N2H4(g)+2H2O2(l)=N2(g)+4H2O(g) ΔH<-641.6 kJ·mol-1 |
您最近一年使用:0次
名校
10 . 已知一定温度下的一些热化学方程式:
N2(g)+O2(g)=2NO(g) △H=+ 180.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(l) △H= -571.6 kJ·mol-1
则该温度下H2催化还原22.4L(标准状况下)NO达到消除环境污染目的的能量变化为
N2(g)+O2(g)=2NO(g) △H=+ 180.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(l) △H= -571.6 kJ·mol-1
则该温度下H2催化还原22.4L(标准状况下)NO达到消除环境污染目的的能量变化为
| A.放出376. 05 kJ | B.放出752.1 kJ |
| C.吸收376.05 kJ | D.吸收752.1kJ |
您最近一年使用:0次
2021-11-18更新
|
346次组卷
|
5卷引用:福建省莆田锦江中学2022-2023学年高二上学期第一次月考化学试题



