名校
1 . 氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔH=________ 。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔH=
您最近一年使用:0次
2 . 已知:NO和 转化为
转化为 的反应机理如下:
的反应机理如下:
①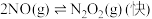
 平衡常数
平衡常数
②
 平衡常数
平衡常数 ;
;
下列说法正确的是
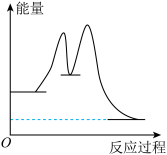
 转化为
转化为 的反应机理如下:
的反应机理如下:①
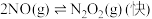
 平衡常数
平衡常数
②

 平衡常数
平衡常数 ;
;下列说法正确的是

A.反应①是决定 反应速率的关键步骤 反应速率的关键步骤 |
B. 的平衡常数 的平衡常数 |
C.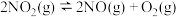 的 的 |
| D.反应过程中的能量变化可用图表示 |
您最近一年使用:0次
2023-11-18更新
|
191次组卷
|
2卷引用:福建省漳州市十校2023-2024学年高二上学期期中联考化学试题
名校
解题方法
3 . 研究化学反应中的能量变化对生产、生活有重要的意义。
(1)甲烷是一种高效清洁的新能源, 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为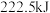 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)已知:


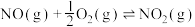


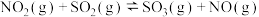


则
___________ (填含 、
、 的表达式),
的表达式),
___________ (填含 、
、 的表达式)。
的表达式)。
(3)已知: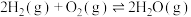
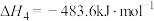 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:
①合成氨反应 的活化能
的活化能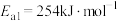 ,则氨分解反应
,则氨分解反应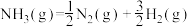 的活化能
的活化能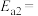
___________  。
。
②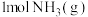 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出___________ kJ的热量;又已知
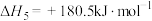 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为___________ 。
(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

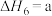
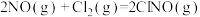
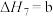
则反应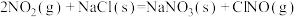 的
的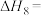
___________ (用含a、b的表达式表示)。
(1)甲烷是一种高效清洁的新能源,
 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为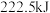 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)已知:



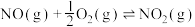


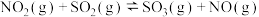


则

 、
、 的表达式),
的表达式),
 、
、 的表达式)。
的表达式)。(3)已知:
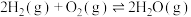
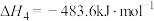 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:| 化学键 | H—H |  | N—H |
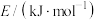 | 436 | 946 | 391 |
 的活化能
的活化能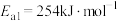 ,则氨分解反应
,则氨分解反应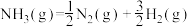 的活化能
的活化能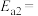
 。
。②
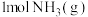 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出
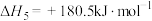 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

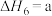
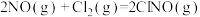
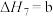
则反应
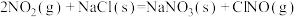 的
的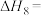
您最近一年使用:0次
2023-11-13更新
|
210次组卷
|
2卷引用:福建省泉州市2023-2024学年高二上学期期中考试化学试题
名校
4 . 已知:
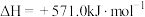 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
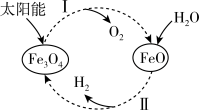
过程Ⅰ: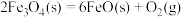
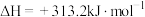
过程Ⅱ:∙∙∙∙∙∙
下列说法不正确的是

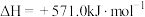 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
过程Ⅰ:
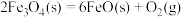
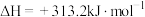
过程Ⅱ:∙∙∙∙∙∙
下列说法不正确的是
A.过程Ⅰ中每消耗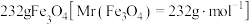 转移 转移 电子 电子 |
| B.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
C.铁氧化合物循环制 具有成本低、产物易分离等优点 具有成本低、产物易分离等优点 |
D.过程Ⅱ的热化学方程式为 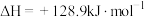 |
您最近一年使用:0次
名校
5 . 完成下列问题。
(1)实验测得16g甲醇 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:___________ 。
(2)合成氨反应
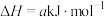 ,能量变化如图所示:
,能量变化如图所示:

①该反应通常用铁作催化剂,加催化剂会使图中
___________ (填“变大”“变小”或“不变”)。
②有关键能数据如下:
试根据表中所列键能数据计算a为___________ 。
(3)现根据下列的3个热化学反应方程式:
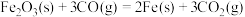

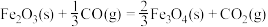
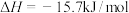

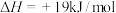
试写出CO气体还原FeO固体得到Fe固体和 气体的热化学反应方程式:
气体的热化学反应方程式:___________ 。
(1)实验测得16g甲醇
 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:(2)合成氨反应

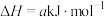 ,能量变化如图所示:
,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中

②有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
键能( ) ) | 436 | 391 | 945 |
(3)现根据下列的3个热化学反应方程式:
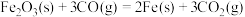

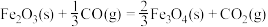
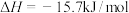

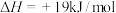
试写出CO气体还原FeO固体得到Fe固体和
 气体的热化学反应方程式:
气体的热化学反应方程式:
您最近一年使用:0次
6 . 已知下列反应的平衡常数:
S(s)+ O2(g)⇌SO2(g),K1;
H2(g) +S(s)⇌H2S(g), K2;
则反应H2(g) +SO2(g)⇌O2(g) +H2S(g)的平衡常数是
S(s)+ O2(g)⇌SO2(g),K1;
H2(g) +S(s)⇌H2S(g), K2;
则反应H2(g) +SO2(g)⇌O2(g) +H2S(g)的平衡常数是
| A.K1+K2 | B.K2−K1 | C.K1 ×K2 | D.K2/K1 |
您最近一年使用:0次
2023-10-24更新
|
201次组卷
|
2卷引用:福建省建瓯市芝华中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为
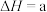 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)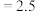 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)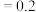 (mol⋅L
(mol⋅L )
)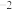 。
。
①
___________ 0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率___________ 消耗 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.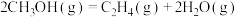
 kJ⋅mol
kJ⋅mol
Ⅱ.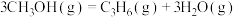
 kJ⋅mol
kJ⋅mol
Ⅲ.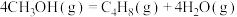
 kJ⋅mol
kJ⋅mol
① 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: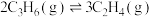
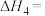
___________ 。
②加入 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将___________ (填“增大”、“减小”或“不变”)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
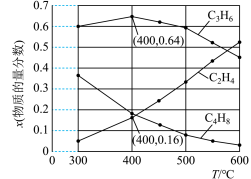
①随着温度的升高, 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是___________ 。
②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数
___________ 。
(1)煤的液化发生的主要反应之一为

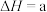 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)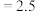 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)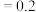 (mol⋅L
(mol⋅L )
)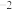 。
。①

②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内
 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.
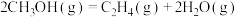
 kJ⋅mol
kJ⋅mol
Ⅱ.
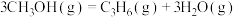
 kJ⋅mol
kJ⋅mol
Ⅲ.
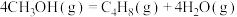
 kJ⋅mol
kJ⋅mol
①
 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: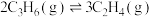
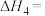
②加入
 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将(3)为研究不同条件对反应的影响,测得不同温度下平衡时
 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
①随着温度的升高,
 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数

您最近一年使用:0次
名校
解题方法
8 . 写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是___________ 。
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2;⑦碳酸钙分解
(2)已知:①C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
③CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
则固态碳和水蒸气反应生成CO和H2的热化学方程式为___________
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应:CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为___________ 。
(4)在2L容器中投入2mol 和bmol
和bmol ,发生反应2SO2+O2=2SO3,下图是部分反应物与生成物随时间的变化曲线。
,发生反应2SO2+O2=2SO3,下图是部分反应物与生成物随时间的变化曲线。
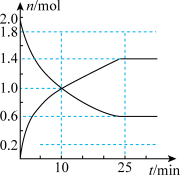
①0~10min内,v(O2)=___________ 。
②反应达到最大限度的时间是___________ min,在该条件下, 的最大转化率为
的最大转化率为___________ 。
③下列条件能够加快反应速率的是___________ (填标号)。
A.升高温度
B.保持体积不变,再充入一定量的氧气
C.保持压强不变,充入He使容积增大
D.保持体积不变,充入He使压强增大
④下列情况能说明该反应达到化学平衡的是___________ 。
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.体系内气体的颜色不再发生改变
D.混合气体的总物质的量不再改变
E. 、
、 、
、 的物质的量之比等于2:1:2
的物质的量之比等于2:1:2
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2;⑦碳酸钙分解
(2)已知:①C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol-1
②H2(g)+
 O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1③CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1则固态碳和水蒸气反应生成CO和H2的热化学方程式为
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
(4)在2L容器中投入2mol
 和bmol
和bmol ,发生反应2SO2+O2=2SO3,下图是部分反应物与生成物随时间的变化曲线。
,发生反应2SO2+O2=2SO3,下图是部分反应物与生成物随时间的变化曲线。
①0~10min内,v(O2)=
②反应达到最大限度的时间是
 的最大转化率为
的最大转化率为③下列条件能够加快反应速率的是
A.升高温度
B.保持体积不变,再充入一定量的氧气
C.保持压强不变,充入He使容积增大
D.保持体积不变,充入He使压强增大
④下列情况能说明该反应达到化学平衡的是
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.体系内气体的颜色不再发生改变
D.混合气体的总物质的量不再改变
E.
 、
、 、
、 的物质的量之比等于2:1:2
的物质的量之比等于2:1:2
您最近一年使用:0次
名校
解题方法
9 . 以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
| A.2ΔH3= -ΔH1-2ΔH2 |
| B.植物的光合作用通过反应①将热能转化为化学能 |
| C.在不同油耗汽车中发生反应③,ΔH3不会不同 |
| D.若反应①生成1.12 L O2,则转移的电子数为0.2×6.02×1023 |
您最近一年使用:0次
2023-09-04更新
|
83次组卷
|
2卷引用:福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
10 . CO2与CH4的催化重整有利于减少空气中的CO2,实现碳中和。
已知:①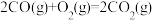 △H1=akJ·mol-1
△H1=akJ·mol-1
② △H2=bkJ·mol-1
△H2=bkJ·mol-1
③ △H3=ckJ·mol-1
△H3=ckJ·mol-1
则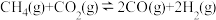 的△H4为
的△H4为
已知:①
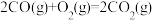 △H1=akJ·mol-1
△H1=akJ·mol-1②
 △H2=bkJ·mol-1
△H2=bkJ·mol-1③
 △H3=ckJ·mol-1
△H3=ckJ·mol-1则
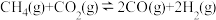 的△H4为
的△H4为| A.(-a-b+c)kJ·mol-1 | B.(a+b-c)kJ·mol-1 |
| C.(-a+b-c)kJ·mol-1 | D.(a-b-c)kJ·mol-1 |
您最近一年使用:0次
2023-08-31更新
|
258次组卷
|
3卷引用:福建省部分名校2023-2024学年高二上学期入学联考化学试题



