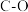解题方法
1 . 积极发展清洁能源,推动经济社会绿色低碳转型,已经成为国际社会应对全球气候变化的普遍共识。已知:
①某些常见化学键的键能(指常温常压下,气态分子中 化学键解离成气态原子所吸收的能量)数据如下:
化学键解离成气态原子所吸收的能量)数据如下:
②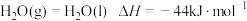 ;
;
③在 和
和 下,
下, 的燃烧热
的燃烧热 。
。
(1)氢能是理想的绿色能源。已知 。
。
①断开1molH—〇需要吸收___________  能量。
能量。
②与天然气相比,氢能的优点是___________ (任写1点)。
(2)CH3OH是一种重要的清洁燃料, 在
在 和
和 下完全燃烧生成
下完全燃烧生成 和
和 时,放出
时,放出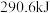 热量。
热量。
①表示 (1)燃烧热的热化学方程式为
(1)燃烧热的热化学方程式为___________ ,该反应中反应物的总键能___________ (填“大于”“小于”或“等于”)生成物的总键能。
②由 催化加氢可制备
催化加氢可制备 ,则
,则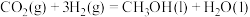

___________  ,若生成气态水,则
,若生成气态水,则
___________ (填“大于”“小于”或“等于”)该计算值。
(3)在 和
和 下,
下, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出 热量,则该混合气体中
热量,则该混合气体中 的物质的量分数为
的物质的量分数为___________  。
。
①某些常见化学键的键能(指常温常压下,气态分子中
 化学键解离成气态原子所吸收的能量)数据如下:
化学键解离成气态原子所吸收的能量)数据如下:| 化学键 |  |  |
键能 | 436 | 496 |
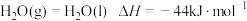 ;
;③在
 和
和 下,
下, 的燃烧热
的燃烧热 。
。(1)氢能是理想的绿色能源。已知
 。
。①断开1molH—〇需要吸收
 能量。
能量。②与天然气相比,氢能的优点是
(2)CH3OH是一种重要的清洁燃料,
 在
在 和
和 下完全燃烧生成
下完全燃烧生成 和
和 时,放出
时,放出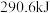 热量。
热量。①表示
 (1)燃烧热的热化学方程式为
(1)燃烧热的热化学方程式为②由
 催化加氢可制备
催化加氢可制备 ,则
,则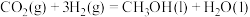

 ,若生成气态水,则
,若生成气态水,则
(3)在
 和
和 下,
下, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出 热量,则该混合气体中
热量,则该混合气体中 的物质的量分数为
的物质的量分数为 。
。
您最近半年使用:0次
名校
2 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: ,该反应体系的能量随反应过程变化关系如图所示,则该反应的
,该反应体系的能量随反应过程变化关系如图所示,则该反应的
_______ (用含a、b的式子表示)。相关化学键的键能如下表,实验测得上述反应的 ,则表中反应过程的x=
,则表中反应过程的x=_______ 。
(2)工业上用 和
和 反应合成二甲醚。
反应合成二甲醚。



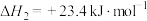
则

_______  。
。
(3)用 表示阿伏加德罗常数的值,在
表示阿伏加德罗常数的值,在 (g)完全燃烧生成
(g)完全燃烧生成 和液态水的反应中,每有5
和液态水的反应中,每有5 个电子转移时,放出650kJ的热量。则
个电子转移时,放出650kJ的热量。则 (g)的燃烧热为
(g)的燃烧热为_______ 。
(4)一定条件下,在水溶液中1mol 、1mol
、1mol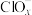 (
( 、2、3、4)的相对能量(kJ)大小如图所示:
、2、3、4)的相对能量(kJ)大小如图所示:_______ (用离子符号表示)。
(1)用
 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: ,该反应体系的能量随反应过程变化关系如图所示,则该反应的
,该反应体系的能量随反应过程变化关系如图所示,则该反应的
 ,则表中反应过程的x=
,则表中反应过程的x=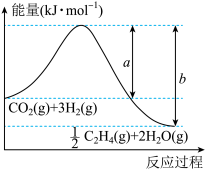
| 化学键 | C=O | H—H | C=C | C—H | H—O |
键能( ) ) | x | 436 | 764 | 414 | 464 |
(2)工业上用
 和
和 反应合成二甲醚。
反应合成二甲醚。


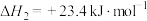
则


 。
。(3)用
 表示阿伏加德罗常数的值,在
表示阿伏加德罗常数的值,在 (g)完全燃烧生成
(g)完全燃烧生成 和液态水的反应中,每有5
和液态水的反应中,每有5 个电子转移时,放出650kJ的热量。则
个电子转移时,放出650kJ的热量。则 (g)的燃烧热为
(g)的燃烧热为(4)一定条件下,在水溶液中1mol
 、1mol
、1mol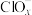 (
( 、2、3、4)的相对能量(kJ)大小如图所示:
、2、3、4)的相对能量(kJ)大小如图所示: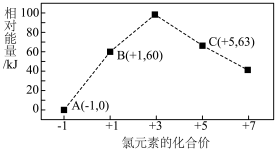
您最近半年使用:0次
名校
解题方法
3 . 已知氮元素及其化合物的转化关系如下图所示,回答下列问题。_______ 。
(2)反应④的离子方程式为_______ 。理论上如图N2合成1mol硝酸,至少需要氧气共_______ mol。
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为_______ 。
①根据上图得知_______ (填字母)。
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是_______ 。

(2)反应④的离子方程式为
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为
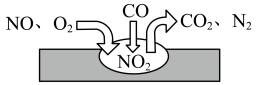

①根据上图得知
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是
您最近半年使用:0次
名校
解题方法
4 . 甲烷( )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:
(1)实验测得 与
与 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量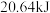 ,则该反应的热化学方程式为
,则该反应的热化学方程式为______________________ 。
(2)已知有关物质的化学键键能数据如下:
试计算反应 的焓变等于
的焓变等于___________ 。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:_______________ 。
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是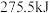 ,硫的燃烧热为
,硫的燃烧热为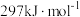 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为___________ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:______________ 。
 )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:(1)实验测得
 与
与 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量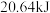 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知有关物质的化学键键能数据如下:
化学链 |
|
|
|
|
|
键能/ | 436 | 343 | 805 | 413 | 465 |
 的焓变等于
的焓变等于(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
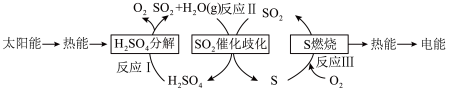
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是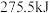 ,硫的燃烧热为
,硫的燃烧热为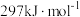 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:

您最近半年使用:0次
名校
解题方法
5 . 科学研究表明: 存储能量的能力是
存储能量的能力是 的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
回答下列问题:
(1)①过程
___________ (填“吸收”或“放出”)能量。
②反应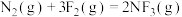
 =
=___________ 。
(2)已知:
①
 ;
;
②
 。
。
现有2mol由炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧生成 (g)和
(g)和 (l),共放出679.0kJ的热量,则2mol悬浮气中C与
(l),共放出679.0kJ的热量,则2mol悬浮气中C与 的物质的量之比为
的物质的量之比为___________ 。
(3)电石( )可通过下列反应制备:
)可通过下列反应制备:
①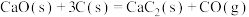
 ;
;
②
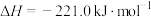 。
。
若不考虑热量损耗,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热量平衡,每生产64g ,投料的量为56g CaO及
,投料的量为56g CaO及___________ mol C、___________ mol  。
。
 存储能量的能力是
存储能量的能力是 的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)
的12000倍左右,在大气中的寿命可达740年,如表所示是几种化学键的键能(断裂或形成1mol化学键时吸收或释放的热量)| 化学键 | N≡N | F—F | N—F |
键能( ) ) | 946 | 154 | 283 |
(1)①过程

②反应
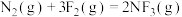
 =
=(2)已知:
①

 ;
;②

 。
。现有2mol由炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧生成
 (g)和
(g)和 (l),共放出679.0kJ的热量,则2mol悬浮气中C与
(l),共放出679.0kJ的热量,则2mol悬浮气中C与 的物质的量之比为
的物质的量之比为(3)电石(
 )可通过下列反应制备:
)可通过下列反应制备:①
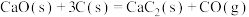
 ;
;②

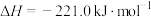 。
。若不考虑热量损耗,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热量平衡,每生产64g
 ,投料的量为56g CaO及
,投料的量为56g CaO及 。
。
您最近半年使用:0次
6 . 化学反应过程中都伴随能量变化,吸热或放热是化学反应中能量变化的重要形式。回答下列问题:
(1)化学反应中伴随热量变化的本质原因是反应过程中形成化学键___________ ,断裂化学键___________ 。
(2)已知拆开1mol H—H键、1mol Cl—Cl键、1mol H—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应 的
的 =
=___________  。
。
(3)已知:
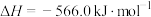 ;
;
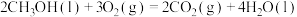
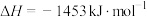 。
。
则 (l)不完全燃烧生成CO和
(l)不完全燃烧生成CO和 (l)的热化学方程式为
(l)的热化学方程式为___________ 。
(4)已知常温常压下,稀的强酸与稀的强碱溶液生成1mol (l)的反应热
(l)的反应热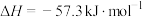 。
。
①表示稀硫酸与稀烧碱溶液生成1mol (l)的热化学方程式为
(l)的热化学方程式为___________ 。
②若用98%浓硫酸代替稀硫酸与稀烧碱溶液进行中和反应反应热测定,则所测得的
___________ (填“偏大”或“偏小”)。
(1)化学反应中伴随热量变化的本质原因是反应过程中形成化学键
(2)已知拆开1mol H—H键、1mol Cl—Cl键、1mol H—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应
 的
的 =
= 。
。(3)已知:

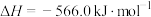 ;
;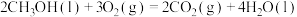
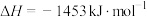 。
。则
 (l)不完全燃烧生成CO和
(l)不完全燃烧生成CO和 (l)的热化学方程式为
(l)的热化学方程式为(4)已知常温常压下,稀的强酸与稀的强碱溶液生成1mol
 (l)的反应热
(l)的反应热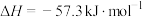 。
。①表示稀硫酸与稀烧碱溶液生成1mol
 (l)的热化学方程式为
(l)的热化学方程式为②若用98%浓硫酸代替稀硫酸与稀烧碱溶液进行中和反应反应热测定,则所测得的

您最近半年使用:0次
名校
解题方法
7 . 已知 (g)和
(g)和 (l)的燃烧热分别是1411.0
(l)的燃烧热分别是1411.0 和1366.8
和1366.8 ,则反应
,则反应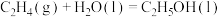 的
的 为
为
 (g)和
(g)和 (l)的燃烧热分别是1411.0
(l)的燃烧热分别是1411.0 和1366.8
和1366.8 ,则反应
,则反应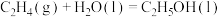 的
的 为
为A.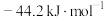 | B.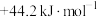 | C.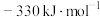 | D. |
您最近半年使用:0次
名校
解题方法
8 . 化学反应的过程既是物质的转化过程,也是化学能与其他形式的能量转化的过程。研究化学反应中的能量变化与研究物质变化具有同样的重要意义。
Ⅰ.汽车尾气中的主要污染物是NOx(包括NO、NO2等氮氧化物)和CO。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图甲所示,则图甲中三种分子中最稳定的是_______ (填化学式)。 CO2(g)+N2(g) △H=Q kJ/mol。有关能量变化过程如图乙所示。
CO2(g)+N2(g) △H=Q kJ/mol。有关能量变化过程如图乙所示。_______ (填“放热”或“吸热”)反应。
(3)在反应体系中加入Pt2O*作为该反应的催化剂,则△H_______ Q kJ/mol (填“>”“<”或“=”)。
Ⅱ.完成下列热化学方程式
(4)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下3.2g SiH4自燃放出热量142.72kJ。SiH4自燃的热化学方程式为_______ 。
(5)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(6)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100g CaCO3沉淀,则表示乙醇燃烧热的热化学方程式为_______ 。
(7)目前我国城市居民所用燃料一般为煤气与石油液化气两种。煤气的主要成分为一氧化碳与氢气,煤气主要是在高温下由煤炭与水蒸气反应制得的;石油液化气的主要成分是C3H8.请回答下列问题:
已知:C3H8(g)+ O2(g)=3CO(g)+4H2(g) △H= -72.7 kJ/mol
O2(g)=3CO(g)+4H2(g) △H= -72.7 kJ/mol
CO(g)+ O2(g)=CO2(g) △H=-283.0 kJ/mol,
O2(g)=CO2(g) △H=-283.0 kJ/mol,
H2(g)+ O2(g)=H2O(l) △H=-285.8k/mol
O2(g)=H2O(l) △H=-285.8k/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1) △H=_______ kJ/mol。
Ⅰ.汽车尾气中的主要污染物是NOx(包括NO、NO2等氮氧化物)和CO。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图甲所示,则图甲中三种分子中最稳定的是
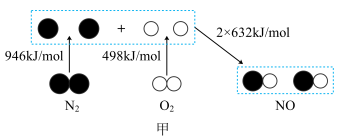
 CO2(g)+N2(g) △H=Q kJ/mol。有关能量变化过程如图乙所示。
CO2(g)+N2(g) △H=Q kJ/mol。有关能量变化过程如图乙所示。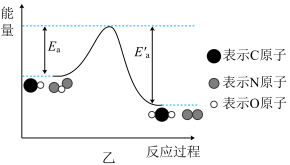
(3)在反应体系中加入Pt2O*作为该反应的催化剂,则△H
Ⅱ.完成下列热化学方程式
(4)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下3.2g SiH4自燃放出热量142.72kJ。SiH4自燃的热化学方程式为
(5)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(6)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100g CaCO3沉淀,则表示乙醇燃烧热的热化学方程式为
(7)目前我国城市居民所用燃料一般为煤气与石油液化气两种。煤气的主要成分为一氧化碳与氢气,煤气主要是在高温下由煤炭与水蒸气反应制得的;石油液化气的主要成分是C3H8.请回答下列问题:
已知:C3H8(g)+
 O2(g)=3CO(g)+4H2(g) △H= -72.7 kJ/mol
O2(g)=3CO(g)+4H2(g) △H= -72.7 kJ/molCO(g)+
 O2(g)=CO2(g) △H=-283.0 kJ/mol,
O2(g)=CO2(g) △H=-283.0 kJ/mol,H2(g)+
 O2(g)=H2O(l) △H=-285.8k/mol
O2(g)=H2O(l) △H=-285.8k/molC3H8(g)+5O2(g)=3CO2(g)+4H2O(1) △H=
您最近半年使用:0次
名校
9 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。___________ 。
(2)反应A的热化学方程式是___________ (注意:不写条件)。
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为___________ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)___________ 。
(4)请回答:
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:___________ 。
(5)已知甲烷的燃烧热为890.3kJ·mol-1,H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=___________ 。
(6)二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:
①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
=-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
=+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:___________ 。
反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.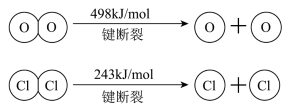
(2)反应A的热化学方程式是
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为
(4)请回答:
| 参加反应的物质及状态 |  |  |  |
| 1mol分子中的化学键断裂时需要吸收的能量 | 436 | a | 369 |
(5)已知甲烷的燃烧热为890.3kJ·mol-1,H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=
(6)二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:
①2H2(g)+O2(g)=2H2O(g)
 = -483.6 kJ·mol-1
= -483.6 kJ·mol-1②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)
 =-1366.8kJ·mol-1
=-1366.8kJ·mol-1③H2O(l)=H2O(g)
 =+44.0kJ·mol-1
=+44.0kJ·mol-1则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:
您最近半年使用:0次
名校
10 . 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是
| 物质 | 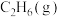 | 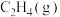 |  |
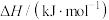 | 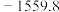 | 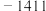 |  |
A.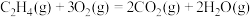 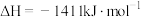 |
B.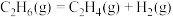 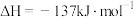 |
C.2H2O(l)=2H2(g)+O2(g) 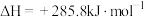 |
D.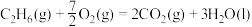  |
您最近半年使用:0次