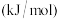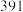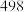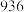解题方法
1 . 回答下列问题
(1) 分子可形成单斜硫和斜方硫,转化过程如下;
分子可形成单斜硫和斜方硫,转化过程如下;
 (单斜,
(单斜, )
)
 (斜方,
(斜方, )
)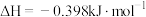 ,则常温下,单斜硫和斜方硫中较稳定的是
,则常温下,单斜硫和斜方硫中较稳定的是_______ 。
(2)已知;①

②

③

则 的
的
_______ 。
(3)肼( )是一种高能燃料,在工业生产中用途广泛,其结构式如图所示:
)是一种高能燃料,在工业生产中用途广泛,其结构式如图所示: 在
在 中燃烧生成
中燃烧生成 和水蒸气,
和水蒸气,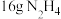 完全反应放出热量为
完全反应放出热量为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为_______
②已知共价键键能如下:
则 中N-N的键能为
中N-N的键能为________  。
。
(4)肼—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示:________ (填“氧化反应”或“还原反应”),
②负极的电极反应式为________ 。
(1)
 分子可形成单斜硫和斜方硫,转化过程如下;
分子可形成单斜硫和斜方硫,转化过程如下; (单斜,
(单斜, )
)
 (斜方,
(斜方, )
)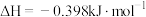 ,则常温下,单斜硫和斜方硫中较稳定的是
,则常温下,单斜硫和斜方硫中较稳定的是(2)已知;①


②


③


则
 的
的
(3)肼(
 )是一种高能燃料,在工业生产中用途广泛,其结构式如图所示:
)是一种高能燃料,在工业生产中用途广泛,其结构式如图所示: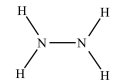
 在
在 中燃烧生成
中燃烧生成 和水蒸气,
和水蒸气,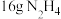 完全反应放出热量为
完全反应放出热量为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为②已知共价键键能如下:
|
|
|
| |
键能 |
|
|
|
|
 中N-N的键能为
中N-N的键能为 。
。(4)肼—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示:

②负极的电极反应式为
您最近半年使用:0次
名校
解题方法
2 . 回答下列问题
(1)已知:
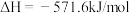

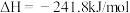
①则氢气的燃烧热
___________ ;
②计算

___________ ;
③计算1g氢气完全燃烧生成气态水时放出___________ kJ的热量。
(2)已知:①
 ;
;
②
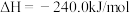 ;
;
③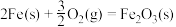
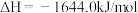 ;
;
则反应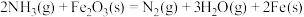

___________  。
。
(1)已知:

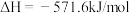

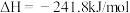
①则氢气的燃烧热

②计算


③计算1g氢气完全燃烧生成气态水时放出
(2)已知:①

 ;
;②

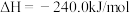 ;
;③
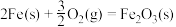
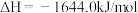 ;
;则反应
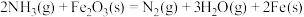

 。
。
您最近半年使用:0次
名校
解题方法
3 . I.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出N2H4的电子式________ 。
(2)写出该反应的热化学方程式________ 。
(3)已知H2O(l)=H2O(g) △H=+44kJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是______ kJ。
(4)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________ 。
II.中和热的测定是高中重要的定量实验.取0.55moL/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:________ 。
(6)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,若实验操作均正确,则所求中和热________ (填“相等”、“不相等”)。
(7)若上述实验测出来的中和热比57.3kJ/mol更小,则产生偏差的原因可能是________ (填字母)。
a.实验装置保温、隔热效果差
b.量取硫酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)写出N2H4的电子式
(2)写出该反应的热化学方程式
(3)已知H2O(l)=H2O(g) △H=+44kJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(4)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
II.中和热的测定是高中重要的定量实验.取0.55moL/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
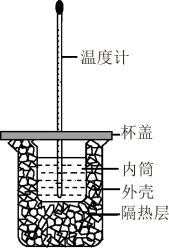
(6)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,若实验操作均正确,则所求中和热
(7)若上述实验测出来的中和热比57.3kJ/mol更小,则产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.量取硫酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
您最近半年使用:0次
名校
4 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。___________ 。
(2)反应A的热化学方程式是___________ (注意:不写条件)。
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为___________ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)___________ 。
(4)请回答:
H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1mol Br2(1)需要吸收的能量为30kJ,则上表中a的数值为:___________ 。
(5)已知甲烷的燃烧热为890.3kJ·mol-1,H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=___________ 。
(6)二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:
①2H2(g)+O2(g)=2H2O(g) = -483.6 kJ·mol-1
= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) =-1366.8kJ·mol-1
=-1366.8kJ·mol-1
③H2O(l)=H2O(g) =+44.0kJ·mol-1
=+44.0kJ·mol-1
则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:___________ 。
反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.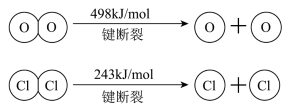
(2)反应A的热化学方程式是
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差为
(4)请回答:
| 参加反应的物质及状态 |  |  | 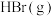 |
| 1mol分子中的化学键断裂时需要吸收的能量 | 436 | a | 369 |
(5)已知甲烷的燃烧热为890.3kJ·mol-1,H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,则甲烷脱硝反应:CH4(g)+2NO(g)+O2(g)=CO2(g)+N2(g)+2H2O(g) ΔH=
(6)二氧化碳经催化氢化可转化成绿色能源乙醇(CH3CH2OH)。已知:
①2H2(g)+O2(g)=2H2O(g)
 = -483.6 kJ·mol-1
= -483.6 kJ·mol-1②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)
 =-1366.8kJ·mol-1
=-1366.8kJ·mol-1③H2O(l)=H2O(g)
 =+44.0kJ·mol-1
=+44.0kJ·mol-1则二氧化碳与氢气转化成CH3CH2OH(l)和液态水的热化学方程式为:
您最近半年使用:0次
名校
5 . 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是
| 物质 | 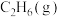 | 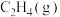 |  |
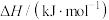 | 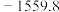 | 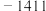 |  |
A.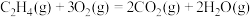 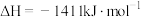 |
B.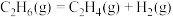 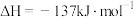 |
C.2H2O(l)=2H2(g)+O2(g) 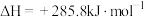 |
D.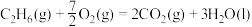  |
您最近半年使用:0次
名校
解题方法
6 . 实验室中药品的保存和实验的安全至关重要,药品的正确保存和实验的规范操作是进行科学实验的基础。
(1)下列关于药品保存或事故处理应对正确的是___________。
(2)Na2SiO3的水溶液俗称水玻璃,在空气中久置后会产生白色胶状沉淀,原因是(用化学反应方程式表示)___________ 。
(3)下列选用的试剂(括号内的物质)不正确的是___________。
(4)实验员小张想要熔融NaOH,他应选用的仪器是___________。
(5)在25℃、101 kPa下,2 g甲醇(CH3OH、液态)完全燃料放热45.36 kJ,写出甲醇燃烧热的热化学方程式___________ 。
(6)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: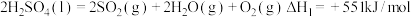
反应Ⅲ: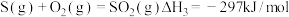
反应Ⅱ的热化学方程式:___________ 。
(1)下列关于药品保存或事故处理应对正确的是___________。
| A.金属钠着火时,用湿抹布覆盖 |
| B.氯水短期保存可以装在棕色细口瓶并置于阴凉处 |
| C.氢氟酸可以保存在玻璃瓶中 |
| D.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
(2)Na2SiO3的水溶液俗称水玻璃,在空气中久置后会产生白色胶状沉淀,原因是(用化学反应方程式表示)
(3)下列选用的试剂(括号内的物质)不正确的是___________。
| A.检验二氧化硫的漂白性(石蕊溶液) |
| B.干燥氨气(无水CaCl2) |
| C.洗涤沾有硫磺的试管(热的NaOH溶液) |
| D.硫酸工业中吸收SO3(浓硫酸) |
(4)实验员小张想要熔融NaOH,他应选用的仪器是___________。
| A.蒸发皿 | B.铁坩埚 | C.氧化铝坩埚 | D.石英坩埚 |
(5)在25℃、101 kPa下,2 g甲醇(CH3OH、液态)完全燃料放热45.36 kJ,写出甲醇燃烧热的热化学方程式
(6)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

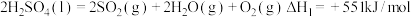
反应Ⅲ:
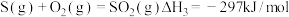
反应Ⅱ的热化学方程式:
您最近半年使用:0次
名校
7 . 温室气体让地球“发烧”,倡导低碳生活,是一种可持续发展的环保责任,将 应用于生产中实现其综合利用是目前的研究热点。回答下列问题:
应用于生产中实现其综合利用是目前的研究热点。回答下列问题:
(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚( )也有广泛的应用。
)也有广泛的应用。
反应I:

反应II:

反应III:
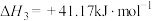
则

___________  。
。
(2)向2L恒容密闭容器中充入 和
和 ,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图所示。
,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图所示。
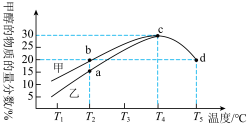
①相同温度下,催化剂效果更好的是___________ (填“甲”或“乙”);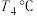 下,甲醇的平均反应速率为
下,甲醇的平均反应速率为___________  。
。
② 和
和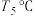 下,平衡常数:
下,平衡常数:
___________ (填“>”、“<”或“=”) 。
。
③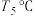 下,反应开始时容器中的总压为
下,反应开始时容器中的总压为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ (只列出计算式,不必化简,气体分压=气体总压×气体的物质的量分数)。
(3)已知 的选择性为
的选择性为 。其他条件相同时,反应温度对
。其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如图I、II所示。
的选择性的影响如图I、II所示。
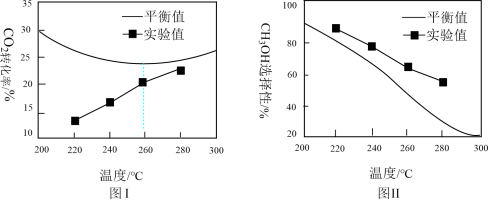
①由图I可知,实验中反应均未达到化学平衡状态的依据是___________ 。
②温度高于260℃时, 的平衡转化率呈上升变化的原因是
的平衡转化率呈上升变化的原因是___________ 。
③由图II可知,温度相同时 选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因
选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因___________ 。
(4)为实现“碳中和”,还可通过电解法用 制备
制备 ,电解装置如图所示。
,电解装置如图所示。

①已知铂电极区溶液呈强酸性,写出铂电极的电极反应式___________ 。
②当玻碳电极收集到标况下22.4L气体时,阴极区增重___________ g。(精确到一位小数)
 应用于生产中实现其综合利用是目前的研究热点。回答下列问题:
应用于生产中实现其综合利用是目前的研究热点。回答下列问题:(1)通过使用不同的新型催化剂,实现二氧化碳加氢合成转化为二甲醚(
 )也有广泛的应用。
)也有广泛的应用。反应I:


反应II:


反应III:

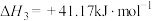
则


 。
。(2)向2L恒容密闭容器中充入
 和
和 ,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图所示。
,在一定条件下,仅发生上述反应I;在甲、乙两种不同催化剂的作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度的变化如图所示。
①相同温度下,催化剂效果更好的是
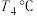 下,甲醇的平均反应速率为
下,甲醇的平均反应速率为 。
。②
 和
和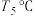 下,平衡常数:
下,平衡常数:
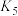 。
。③
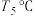 下,反应开始时容器中的总压为
下,反应开始时容器中的总压为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
(3)已知
 的选择性为
的选择性为 。其他条件相同时,反应温度对
。其他条件相同时,反应温度对 的转化率和
的转化率和 的选择性的影响如图I、II所示。
的选择性的影响如图I、II所示。
①由图I可知,实验中反应均未达到化学平衡状态的依据是
②温度高于260℃时,
 的平衡转化率呈上升变化的原因是
的平衡转化率呈上升变化的原因是③由图II可知,温度相同时
 选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因
选择性的实验值略高于其平衡值,从化学反应速率的角度解释其原因(4)为实现“碳中和”,还可通过电解法用
 制备
制备 ,电解装置如图所示。
,电解装置如图所示。
①已知铂电极区溶液呈强酸性,写出铂电极的电极反应式
②当玻碳电极收集到标况下22.4L气体时,阴极区增重
您最近半年使用:0次
名校
解题方法
8 . 二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
(1)已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=a kJ•mol-1
CO2(g) + H2(g)=CO(g) + H2O(g) ΔH2=b kJ•mol-1
2CO(g)+O2 (g)=2CO2(g) ΔH3=c kJ•mol-1
则催化重整反应CO2(g) + CH4(g) 2CO(g) + 2H2(g)的ΔH4=
2CO(g) + 2H2(g)的ΔH4=___________ 。
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是
___________ 。
A.2v(NH3)=v(CO2) B.密闭容器中c(NH3):c(CO2)=2:1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.密闭容器内压强不变 F.密闭容器中混合气体平均相对分子质量不变
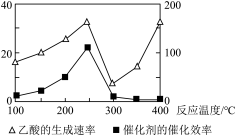
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,250~300℃时,温度升高而乙酸的生成速率降低的原因可能是
___________ 。
(4)饮用水中的NO
 主要来自于NH
主要来自于NH
 。已知在微生物的作用下,NH
。已知在微生物的作用下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO
 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
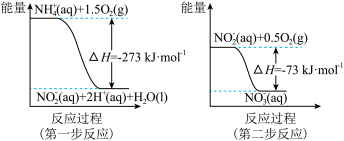
1 mol NH 全部被氧化成NO
全部被氧化成NO 的热化学方程式为
的热化学方程式为___________ 。
(5)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示图中有机废水中有机物可用C6H10O5表示,回答下列问题。
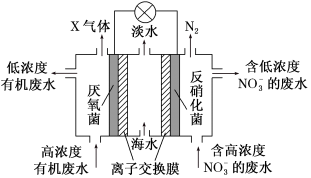
①海水中的Na+由中间室移向___________ (选填“左”或“右”)室。
②该电池负极的电极反应方程式为___________ 。
③电路中每通过1 mol电子,产生标准状况下气体的体积为___________ L。
(1)已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=a kJ•mol-1
CO2(g) + H2(g)=CO(g) + H2O(g) ΔH2=b kJ•mol-1
2CO(g)+O2 (g)=2CO2(g) ΔH3=c kJ•mol-1
则催化重整反应CO2(g) + CH4(g)
 2CO(g) + 2H2(g)的ΔH4=
2CO(g) + 2H2(g)的ΔH4=(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是A.2v(NH3)=v(CO2) B.密闭容器中c(NH3):c(CO2)=2:1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.密闭容器内压强不变 F.密闭容器中混合气体平均相对分子质量不变
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,250~300℃时,温度升高而乙酸的生成速率降低的原因可能是

(4)饮用水中的NO
 主要来自于NH
主要来自于NH 。已知在微生物的作用下,NH
。已知在微生物的作用下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
1 mol NH
 全部被氧化成NO
全部被氧化成NO 的热化学方程式为
的热化学方程式为(5)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示图中有机废水中有机物可用C6H10O5表示,回答下列问题。

①海水中的Na+由中间室移向
②该电池负极的电极反应方程式为
③电路中每通过1 mol电子,产生标准状况下气体的体积为
您最近半年使用:0次
名校
9 . 用CH4催化还原NOx,可以消除氮氧化物的污染。下列说法正确的是
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ/mol
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ/mol
| A.若用0.1molCH4还原NO2生成N2和水蒸气,放出的热量为86.7kJ |
| B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH>-574kJ/mol |
| C.等量甲烷参与反应时,①②转移的电子数相同 |
| D.若反应②放出116kJ热量,则生成4.48LN2 |
您最近半年使用:0次
10 . 2023年政府工作报告提出要稳步推进节能降碳,工业上可将CO2与合成气(CO和H2)在催化剂作用下合成甲醇,以减少CO2的排放。有关反应的热化学方程式如下:
① ;
;
②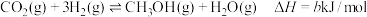 ;
;
③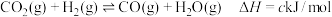 。
。
回答下列问题:
(1)上述反应符合“原子经济性”的是________ (选填序号)。
(2)计算c=___________ (用a、b表示)。
(3)恒容密闭容器中,对于③反应,下列措施不能 加快反应速率的是___________。
(4)在一定温度下,在体积为2L的密闭容器中,充入1molCO2和3molH2,控制条件按②反应进行,测得CH3OH的物质的量随时间变化如图。

①下列叙述能表示该反应达到平衡状态的是________ (填标号)。
A.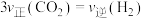 B.CO2的转化率不再改变
B.CO2的转化率不再改变
B.混合气体的密度不再改变 D.CO2与H2物质的量比不再变化
②CH3OH在0~5min内的平均反应速率为________ mol/(L·min);比较0~5min与5min~15min两个时间段的平均反应速率大小并解释其变化的原因________ 。
①
 ;
;②
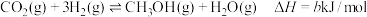 ;
;③
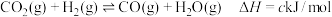 。
。回答下列问题:
(1)上述反应符合“原子经济性”的是
(2)计算c=
(3)恒容密闭容器中,对于③反应,下列措施
| A.增加CO2浓度 | B.加入催化剂 | C.升高温度 | D.降低压强 |

①下列叙述能表示该反应达到平衡状态的是
A.
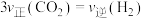 B.CO2的转化率不再改变
B.CO2的转化率不再改变B.混合气体的密度不再改变 D.CO2与H2物质的量比不再变化
②CH3OH在0~5min内的平均反应速率为
您最近半年使用:0次