解题方法
1 . 回答问题:
(1)已知C(s、金刚石)+O2(g)=CO2(g) △H=-395.4 kJ·mol-1,C(s、石墨)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。则石墨中C-C键键能____ (填“大于”“小于”或“等于”)金刚石中C-C键键能。
(2)已知下列反应的反应热:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____ 。
(1)已知C(s、金刚石)+O2(g)=CO2(g) △H=-395.4 kJ·mol-1,C(s、石墨)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。则石墨中C-C键键能
(2)已知下列反应的反应热:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
您最近一年使用:0次
2 . 请按要求回答下列问题。
(1)写出下列物质在水溶液中的电离方程式
①HClO:_______ ;
②H2SO3:_______ ;
③NaHCO3:_______ ;
④Cu(OH)2:_______ 。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(3)在25 ℃、101 kPa时,H2在O2中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为_______ 。
(4)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1①
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②
则CH4与O2反应生成CO和H2的热化学方程式为_______ 。
(1)写出下列物质在水溶液中的电离方程式
①HClO:
②H2SO3:
③NaHCO3:
④Cu(OH)2:
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(3)在25 ℃、101 kPa时,H2在O2中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为
(4)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1①
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②
则CH4与O2反应生成CO和H2的热化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 依据事实,写出下列反应的热化学方程式。
(1)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol液态H2O,放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为_______ 。
(2)已知CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。写出CH3OH(l)不完全燃烧生成CO和液态水的热化学方程式_______ 。
(3)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ的热量,表示其中和热的热化学方程式_______ 。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_______ 。
(1)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol液态H2O,放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为
(2)已知CO(g)和CH3OH(l)的燃烧热ΔH分别为-283.0kJ·mol-1和-726.5kJ·mol-1。写出CH3OH(l)不完全燃烧生成CO和液态水的热化学方程式
(3)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ的热量,表示其中和热的热化学方程式
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是
您最近一年使用:0次
4 . 氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
①ΔH 1___________ 0,ΔH 3___________ 0.(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=___________ kJ·mol-1
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是___________ (填字母)。
A.
B.
C 。
。
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=___________ ,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为___________ kJ。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
| 反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
| 反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
| 热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1
②N2(g)+O2(g) = 2NO(g) ΔH=
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是
A.

B.

C
 。
。(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=
您最近一年使用:0次
名校
解题方法
5 . 盖斯定律是人们研究热化学的重要工具和方法。
(1)已知1molSi固体中有2molSi—Si键,1molO2中有1molO=O键,1molSiO2固体中有4molSi-O键。某些化学键键能(1mol化学键断裂需要吸收的能量)数据如下:
根据化学键数据写出Si(s)在O2中完全燃烧生成SiO2的热化学方式:___________ 。
(2)肼(N2H4)通常作为火箭的燃料。已知3.2g液态肼在O2(g)中完全燃烧,生成N2(g)和H2O(l),放出62.2kJ热量,写出上述反应的热化学方程式:______
(3)煤加工的重要手段是煤的气化,如用煤合成水煤气的原理为C(s)+H2O(g) CO(g)+H2(g) △H。
CO(g)+H2(g) △H。
已知: C(s)+O2(g)=CO2(g) △H=-393.35 kJ·mol-1

CO(g) + O2(g)=CO2(g) △H=-283.0 kJ·mol-1
O2(g)=CO2(g) △H=-283.0 kJ·mol-1
求:①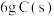 完全燃烧放出的热量为
完全燃烧放出的热量为___________ kJ。
②C(s)+ H2O(g)= CO(g) +H2(g) △H=___________ 。
(1)已知1molSi固体中有2molSi—Si键,1molO2中有1molO=O键,1molSiO2固体中有4molSi-O键。某些化学键键能(1mol化学键断裂需要吸收的能量)数据如下:
| 化学键 | Si—O | Si—Si | O=O |
| 键能(kJ·mol-1) | 460 | 176 | 498 |
根据化学键数据写出Si(s)在O2中完全燃烧生成SiO2的热化学方式:
(2)肼(N2H4)通常作为火箭的燃料。已知3.2g液态肼在O2(g)中完全燃烧,生成N2(g)和H2O(l),放出62.2kJ热量,写出上述反应的热化学方程式:
(3)煤加工的重要手段是煤的气化,如用煤合成水煤气的原理为C(s)+H2O(g)
 CO(g)+H2(g) △H。
CO(g)+H2(g) △H。已知: C(s)+O2(g)=CO2(g) △H=-393.35 kJ·mol-1

CO(g) +
 O2(g)=CO2(g) △H=-283.0 kJ·mol-1
O2(g)=CO2(g) △H=-283.0 kJ·mol-1求:①
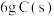 完全燃烧放出的热量为
完全燃烧放出的热量为②C(s)+ H2O(g)= CO(g) +H2(g) △H=
您最近一年使用:0次
解题方法
6 . 已知下列热化学方程式:
①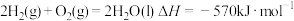
②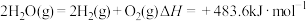
③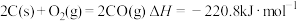
④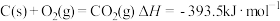
回答下列问题:
(1)上述反应中属于放热反应的是___________ (填写序号)。
(2) 的燃烧热为
的燃烧热为___________ 。
(3)燃烧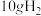 生成液态水,放出的热量为
生成液态水,放出的热量为___________ 。
(4) 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为___________ 。
(5)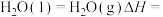
___________ 。
①
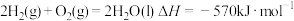
②
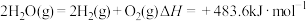
③
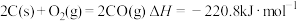
④
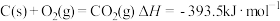
回答下列问题:
(1)上述反应中属于放热反应的是
(2)
 的燃烧热为
的燃烧热为(3)燃烧
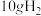 生成液态水,放出的热量为
生成液态水,放出的热量为(4)
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(5)
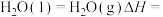
您最近一年使用:0次
2021-11-09更新
|
89次组卷
|
2卷引用:黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
解题方法
7 . 回答下列问题:
(1)已知:
①P4(s、白磷)+5O2(g)=P4O10(s) ΔH 1=-2983.2 kJ/mol
②P(s、红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH 2= -738.5 kJ/mol
P4O10(s) ΔH 2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式___________ 。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________ ,表示其中和热的热化学方程式为___________ 。
(3)已知水的比热容为c=4.18J·(g·℃)-1,10g 硫黄在 O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫黄的燃烧热为___________ ,热化学方程式为___________ 。
(1)已知:
①P4(s、白磷)+5O2(g)=P4O10(s) ΔH 1=-2983.2 kJ/mol
②P(s、红磷)+
 O2(g)=
O2(g)= P4O10(s) ΔH 2= -738.5 kJ/mol
P4O10(s) ΔH 2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为
(3)已知水的比热容为c=4.18J·(g·℃)-1,10g 硫黄在 O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫黄的燃烧热为
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为___ (填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___ 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=___ kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为___ 。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为___ 。
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为
您最近一年使用:0次
9 . 回答下列问题
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1
反应Ⅱ:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
则反应Ⅰ的ΔH1=___________ kJ·mol-1。
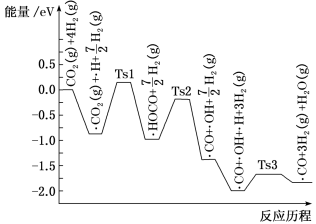
(2)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会___________ (填“放出热量”或“吸收热量”);反应历程中最小能垒步骤的化学方程式为___________ 。
(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ·mol-1、890.31 kJ·mol-1、1167.9 kJ·mol-1,则乙醛的分解反应CH3CHO(l) CH4(g)+CO(g)的ΔH=
CH4(g)+CO(g)的ΔH=___________ 。
(4)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是___________ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1反应Ⅱ:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1总反应:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1则反应Ⅰ的ΔH1=
(2)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会
(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ·mol-1、890.31 kJ·mol-1、1167.9 kJ·mol-1,则乙醛的分解反应CH3CHO(l)
 CH4(g)+CO(g)的ΔH=
CH4(g)+CO(g)的ΔH=(4)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
名校
解题方法
10 . 化学反应所提供的能量大大促进了社会的发展。请回答下列问题:
(1)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作火箭和导弹表面的耐高温材料: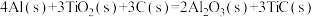
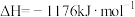 ,该反应过程中,每转移1 mol电子放出的热量为
,该反应过程中,每转移1 mol电子放出的热量为___________ 。
(2)键能可用于估算化学反应的反应热。已知白磷的燃烧热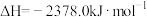 ,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=___________ 。
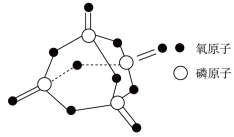
(3)我国科学家实现了在铜催化条件下将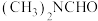 转化为
转化为 。计算机模拟
。计算机模拟单个分子 在铜催化剂表面的反应历程如图所示。
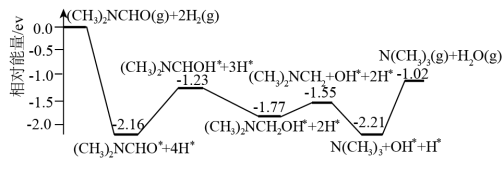
用相对能量 的变化来表示 ,写出该反应的热化学方程式
,写出该反应的热化学方程式___________ 。
(4)处理废水中的 可在微生物的作用下经过两步反应转化为
可在微生物的作用下经过两步反应转化为 ,两步反应的能量变化如图所示:
,两步反应的能量变化如图所示:
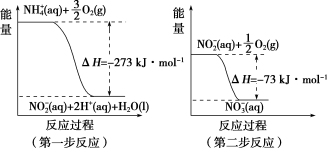
则1 mol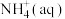 被氧化成
被氧化成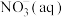 的热化学方程式是
的热化学方程式是___________ 。
(5)已知25℃和101 kPa下:
①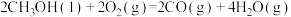
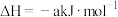
②
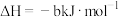
③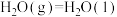

则表示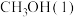 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(1)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作火箭和导弹表面的耐高温材料:
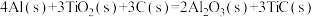
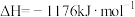 ,该反应过程中,每转移1 mol电子放出的热量为
,该反应过程中,每转移1 mol电子放出的热量为(2)键能可用于估算化学反应的反应热。已知白磷的燃烧热
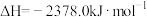 ,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
| 化学键 | P-P | P-O | O=O | P=O |
键能/( ) ) | X | 335 | 498 | 470 |
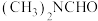 转化为
转化为 。计算机模拟
。计算机模拟
用
 ,写出该反应的热化学方程式
,写出该反应的热化学方程式(4)处理废水中的
 可在微生物的作用下经过两步反应转化为
可在微生物的作用下经过两步反应转化为 ,两步反应的能量变化如图所示:
,两步反应的能量变化如图所示:
则1 mol
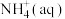 被氧化成
被氧化成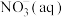 的热化学方程式是
的热化学方程式是(5)已知25℃和101 kPa下:
①
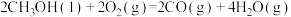
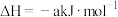
②

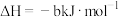
③
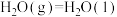

则表示
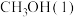 燃烧热的热化学方程式为
燃烧热的热化学方程式为
您最近一年使用:0次



